Статьи
NATURE. Назад в будущее сохранения фертильности. 17 декабря 2024
Оглавление:
- Введение
- ЛГ-активность, обеспечиваемая ХГЧ, в протоколах овариальной стимуляции: Почему, когда и как (Из лекции проф. Ernesto Bosch)
- Синергизм гонадотропинов важен для созревания ооцитов
- Влияют ли различные эндокринные профили на качество эмбриона?
- Особенности у пациенток молодого и старшего репродуктивного возраста
- Влияние эндокринного профиля на показатели продолжающейся беременности и родов живым плодом
- Выводы
Введение
В рамках 46-го Международного конгресса, прошедшего на базе университетского госпиталя Dexeus (Барселона, Испания, 25-27 апреля 2024 г.) были продемонстрированы достижения последних лет в области генетики, эмбриологии, андрологии, сохранения фертильности и вспомогательных репродуктивных технологий (ВРТ).
Ключевым событием конгресса стал сателлитный симпозиум «От овариальной стимуляции до поддержки лютеиновой фазы: карта возможностей повышения результативности протоколов ВРТ», спонсорская поддержка которого осуществлялась Международной федерацией спорта слепых (the International Blind Sports Federation, IBSA). Данный симпозиум, ведущим которого выступил Julio Herrero (Испания), ознаменовался выступлениями таких выдающихся спикеров, как Ernesto Bosch и Manuel Álvarez Almodóvar.
В своем докладе Ernesto Bosch (IVIRMA, Валенсия, Испания) проиллюстрировал различные гормональные пути, активируемые двумя препаратами гонадотропинов с и без ЛГ-активности, обеспечиваемой ХГЧ.
Manuel Álvarez Almodóvar (Университетский госпиталь Dexeus, Барселона, Испания) рассмотрел вопрос актуальности назначения препаратов прогестерона в циклах криопереноса и подчеркнул необходимость поддержания физиологических уровней данного гормона для обеспечения наилучших показателей результативности протоколов вне зависимости от вида последних.
ЛГ-активность, обеспечиваемая ХГЧ, в протоколах овариальной стимуляции: Почему, когда и как
Из лекции проф. Ernesto Bosch (IVIRMA, Валенсия, Испания)
Чтобы повысить результативность овариальной стимуляции, необходимо углубиться в физиологию и патофизиологию механизмов последней. Так, ранний этап развития фолликулов в яичнике протекает независимо от уровня гормонов гипофиза: фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов.
|
Гормональные вмешательства на раннем этапе фолликулогенеза нецелесообразны, поскольку фолликулы на начальном этапе своего развития не чувствительны к гонадотропинам.
|
Рост фолликулов на первой стадии регулируется аутокринными и паракринными влияниями, т.е. сигнальными молекулами, секретируемыми самим фолликулом или клетками его микроокружения. Данная стадия негормонально-зависимая, в связи с чем повлиять на развитие фолликулов на данном этапе с помощью назначения гормональных препаратов (в частности, гонадотропинов) не представляется возможным. Чувствительность к гормональным воздействиям появляется лишь на стадии рекрутирования примордиальных фолликулов преантральной фазы фолликулогенеза, когда происходит переход от состояния покоя до стадии роста, контролируемый преимущественно уровнем ФСГ. Наибольшее число клеток гранулезного слоя и рецепторов к ФСГ, ЛГ содержит доминантный фолликул, при этом определяющим на данном этапе служит уровень ЛГ.
Синергизм гонадотропинов важен для созревания ооцитов
Ранние антральные фолликулы содержат рецепторы к ЛГ и ФСГ в клетках теки и гранулезы соответственно. Воздействие на рецепторы к ФСГ инициирует экспрессию рецепторов к ЛГ и ароматазе клетками гранулезы, делая фолликулы чувствительными как к ФСГ, так и ЛГ. Синергетическое воздействие гонадотропинов необходимо для обеспечения созревания и компетентности ооцитов, т.е. их способности в конечном счете привести к наступлению клинической беременности (Casarini et al. 2018) (рисунок 1).
Рисунок 1. Участие гонадотропинов в фолликулогенезе в физиологических условиях (адаптировано Casarini и соавт. Endocr Rev 2018)
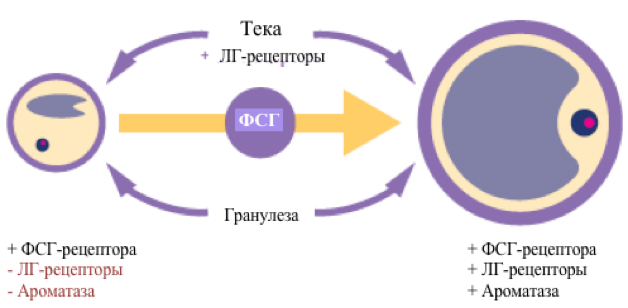
Лишь фолликул с наибольшей чувствительностью к ФСГ, достигший диаметра 10 мм, среди всех фолликулов, подвергшихся воздействию последнего, приобретает чувствительность к ЛГ и становится доминантным. Гранулеза лидирующего фолликула начинает вырабатывать гормон ингибин А, который способствует снижению уровня ФСГ, что приводит к обратному развитию и атрезии тех фолликулов, рост которых полностью контролируется уровнем ФСГ (2-10 мм в диаметре). Эта концепция соответствует теории «многие призваны, но немногие избраны», предложенной Zeleznik (Zeleznik 2001).
|
События фолликулогенеза наглядно иллюстрирует теория Zeleznik - «многие призваны, но немногие избраны»
|
Синтез ЛГ и ФСГ регулируется гипоталамо-гипофизарно-яичниковой осью. Наличие индивидуальных особенностей уровней ЛГ и ФСГ в популяции, зачастую генетически детерминированных, обусловлено пульсирующим характером секреции гонадотропин-рилизинг-гормона (ГнРГ), существованием различных паттернов гликозилирования гонадотропинов, являющегося важнейшим механизмом регуляции их активности, а также полиморфизмов генов субъединиц гонадотропинов. Кроме того, активность ЛГ и ФСГ может зависеть от наличия полиморфизмов рецепторов к данным гормонам в яичниках (Bosch и соавт. 2021).
Физиологический фолликулярный стероидогенез включает два альтернативных метаболических пути:
- Прегненолоновый (Δ5) путь: по этому пути синтезируются андрогены и эстрогены (холестерин → прегненолон → 170Н-прегненолон → дегидроэпиандростерон (ДГЭА, под действием цитохрома P450c17 в тека-клетках) → тестостерон → эстроген (посредством ароматизации в клетках гранулезы).
- Прогестероновый (Δ4) путь: прегненолон → прогестерон (в результате метаболизма в клетках гранулезы, где фермент, необходимый для превращения последнего в андрогены, не экспрессируется). Таким образом, прогестерон является конечным продуктом этого альтернативного пути (Bosch et al. 2024).
Влияют ли различные эндокринные профили на качество эмбриона?
В литературе, посвященной экстракорпоральному оплодотворению (ЭКО) и интрацитоплазматической инъекции сперматозоидов в цитоплазму ооцита (ИКСИ) имеется много данных о сравнительной эффективности применения высокоочищенного человеческого менотропина (высокоочищенного человеческого менопаузального гонадотропина, ЧМГ, hp-HMG) и рекомбинантного ФСГ (р-ФСГ, r-FSH). Объединенные данные свидетельствуют о несколько более высоких показателях рождаемости (5%) в случае назначения ЧМГ в сравнении с р-ФСГ у пациенток с нормальным овариальным ответом (Santi и соавт. 2017).
Влияют ли различия в эндокринных профилях при назначении ЧМГ и р-ФСГ на качество эмбриона и/или рецептивность эндометрия? На показатели продолжающейся беременности и родов живым плодом? Данные вопросы являются основополагающими.
Согласно результатам одного из крупнейших классических исследований, сравнивающих показатели продолжающейся беременности у женщин, которым с целью овариальной стимуляции в рамках программы ЭКО назначались ЧМГ или р-ФСГ после длинного протокола с агонистом ГнРГ, назначение ЧМГ приводило к получение меньшего числа ооцитов более высокого качества (Andersen и соавт. 2006). Аналогично, данные рандомизированного контролируемого исследования Bosch и соавт., сравнивающего показатели продолжающейся беременности у пациенток, получавших ЧМГ или р-ФСГ для овариальной стимуляции в протоколах ЭКО/ИКСИ с антГнРГ, свидетельствуют о том, что применение ЧМГ сопровождается более высокими показателями продолжающейся беременности по сравнению с р-ФСГ, однако эта разница незначительна (Bosch и соавт. 2008).
|
Назначение ЧМГ в протоколах овариальной стимуляции позволяет получить ооциты более высокого качества при пункции
|
Основываясь на данных, указанных выше, исследователи провели дальнейшее изучение потенциальных преимуществ назначения ЧМГ в рамках более крупного многоцентрового исследования MEGASET. Были также продемонстрированы немного более высокие показатели продолжающейся беременности на начатый цикл и перенос при овариальной стимуляции с ЧМГ в сравнении с р-ФСГ. Были отмечены различия в динамике развития фолликулов между двумя группами. Так, в группе ЧМГ на фоне большого числа развивающихся фолликулов при пункции было получено не более 7 ооцитов, в то время как в группе р-ФСГ отмечалось большее количество зрелых ооцитов (Devroy и соавт. 2012).
Witz и соавт. оценили эффективность и безопасность применения ЧМГ и р-ФСГ для контролируемой овариальной стимуляции в когорте 620 пациенток с высоким ответом. Анализ полученных данных показал, что р-ФСГ стимулировал рост большего количества фолликулов в целом, тогда как применение ЧМГ было ассоциировано с более высокой частотой наступления клинической беременности на цикл (на 5%), немного более высокой частотой родов живым плодом при переносе эмбрионов в свежем цикле и значительно более высокой частотой родов живым плодом при криопереносе (на 12%) (Witz и соавт. 2020). Частота ранних потерь беременности и число переносов эмбрионов до наступления клинической беременности в группе ЧМГ, напротив, были ниже. Однако, кумулятивная частота родов живым плодом среди групп была сопоставима. В целом, у пациенток с высоким ответом яичников на овариальную стимуляцию число попыток, необходимых для достижения клинической беременности, закономерно ниже. С другой стороны, увеличение количества полученных за одну попытку ооцитов сопряжено со значительным повышением риска синдрома гиперстимуляции яичников (СГЯ) в группе р-ФСГ. Применение ЧМГ в силу большей безопасности и эффективности последнего позволяло снизить затраты на попытку стимуляции с последующими родами живым плодом, в среднем, на 3000 долларов (Khair и соавт. 2023).
Особенности у пациенток молодого и старшего репродуктивного возраста
При угасании функции яичников повышение уровня ФСГ не сопровождается возрастанием концентрации ЛГ, что приводит к гормональному дисбалансу, выражающемуся в сокращении фолликулярной фазы менструального цикла и преждевременной овуляции при меньшем, чем в естественном менструальном цикле на фоне адекватной работы яичников, диаметре фолликула (Klein и соавт. 1996). Кроме того, приближение менопаузы ассоциировано со снижением уровня андрогенов. Так, в ходе исследования, проведенного в Австралии, было прослежено снижение уровня андрогенов в период от менархе до менопаузы, при этом уровень общего тестостерона сокращался на 55%, а падение дегидроэпиандростерон сульфата (ДГЭА-С) достигало 77% (Davison и соавт. 2005). Другими словами, у женщин старшего репродуктивного возраста отмечается снижение синтеза андрогенов в сравнении с молодыми женщинами, проходящими протокол овариальной стимуляции.
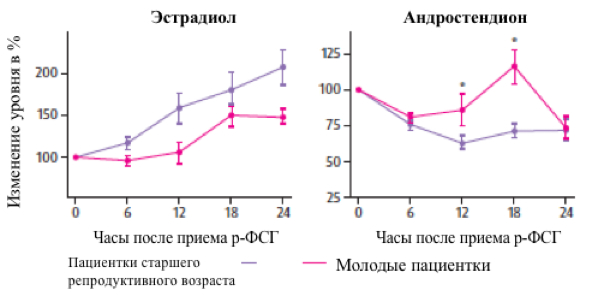
Однако, это не единственное различие между пациентками молодого и старшего репродуктивного возраста. Физиологические изменения, происходящие на фоне угасания функции яичников, обуславливают особенности ответа последних на стимуляцию р-ФСГ. Под воздействием р-ФСГ в фолликулах молодых пациенток вырабатывается как эстрадиол, так и андростендион, в то время как у пациенток старшей возрастной группы на фоне применения р-ФСГ при достаточном синтезе эстрадиола выработка андростендиона повышается лишь незначительно (Welt и соавт. 2006) (рисунок 2). Таким образом, способность яичников пациенток старшего репродуктивного возраста вырабатывать андрогены в ответ на стимуляцию гонадотропинами, по-видимому, снижена.
Рисунок 2. Угасание функции яичников: различия между пациентками молодого и старшего репродуктивного возраста в динамике фолликулярного ответа на стимуляцию р-ФСГ (адаптировано из Welt и соавт. Hum Reprod 2006)
Влияние эндокринного профиля на показатели продолжающейся беременности и родов живым плодом
Эндокринный профиль в сыворотке крови и фолликулярной жидкости у пациенток, прошедших стимуляцию овуляции ЧМГ или р-ФСГ различен: применение ЧМГ сопровождается повышением уровней эстрадиола, андростендиона и тестостерона до более высоких значений весь период стимуляции. В фолликулярной жидкости, полученной у пациенток, стимулированных ЧМГ, отмечаются более высокие уровни андрогенов и эстрогенов, а при стимуляции р-ФСГ - прогестерона (Smitz и соавт. 2007). Было выявлено, что более высокие уровни прогестерона в протоколах овариальной стимуляции ассоциированы с более низкой результативностью переноса эмбрионов в свежем цикле, при этом выраженность подобного негативного влияния коррелирует с продолжительностью воздействия данного гормона (Bosch и соавт. 2010; Huang и соавт. 2012). Однако, основные патофизиологические механизмы влияния прогестерона и пути оптимизации уровня последнего до конца не ясны. С целью дальнейшего их изучения, Bosch и соавт. провели комплексное исследование, направленное на сравнительную оценку влияния ЧМГ и р-ФСГ на выработку прогестерона в фолликулярной фазе в протоколах овариальной стимуляции. Авторы также стремились изучить, вытекают ли эти изменения из различий в фолликулярном стероидогенезе (Bosch и соавт. 2024).
|
Профилактирует ли овариальная стимуляция с применением ЧМГ избыточное повышение прогестерона в фолликулярной фазе менструального цикла в сравнении с р-ФСГ ввиду особенностей фолликулярного стероидогенеза?
|
В этом одноцентровом открытом рандомизированном контролируемом исследовании 110 участниц были случайным образом распределены на две группы: 1) получавшие р-ФСГ в начальной дозе 225 МЕ/сут; 2) получавшие ЧМГ в начальной дозе 225 МЕ/сут. В ходе исследования осуществлялся тщательный контроль всех гормонов, участвующих в фолликулярном стероидогенезе (ФСГ, ЛГ, эстрадиола, прогестерона, 17-OH-прогестерона, прегненолона, андростендиона, дигидротестостерон сульфата, тестостерона и эстрона), уровень которых оценивался на 1, 4, 6 и 8 дни стимуляции, а также в день введения триггера финального созревания ооцитов. Помимо этого, исследователи определяли уровни данных гормонов в фолликулярной жидкости, полученной из доминантного фолликула в ходе забора ооцитов (Bosch и соавт. 2024).
Пациентки обеих групп были молодого возраста с нормальными показателями индекса массы тела (ИМТ), овариального резерва, фертильности. Результаты предшествующих циклов овариальной стимуляции, в частности, общее число фолликулов, количество ооцитов, в том числе, достигших зрелости, были также сопоставимы (Bosch и соавт. 2024).
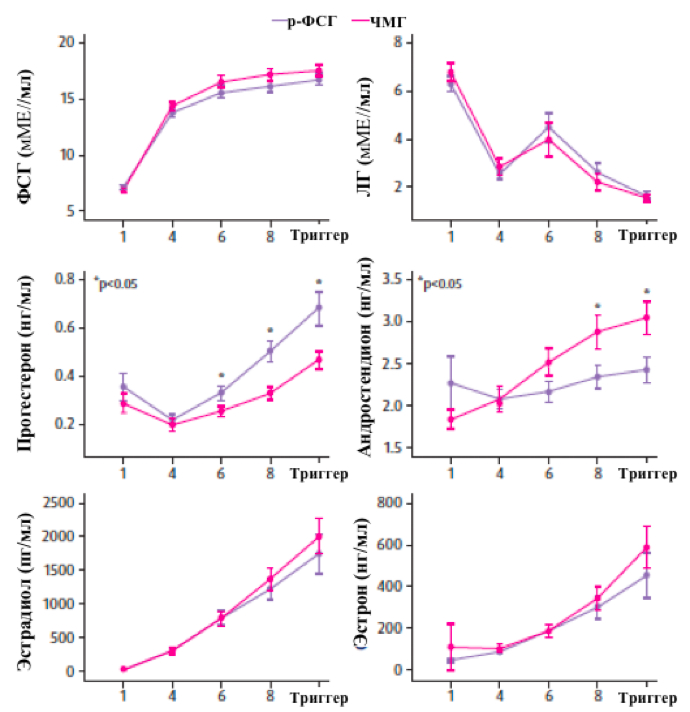
В конце стимуляции в группе р-ФСГ отмечались значительно более высокие уровни сывороточного прогестерона. Эта разница становилась еще более выраженной при рассмотрении содержания прогестерона на единицу массы фолликула. Значимых различий в профилях ФСГ и ЛГ в период стимуляции между группами не отмечалось (что было ожидаемо ввиду назначения одинаковых доз ФСГ в отсутствие дополнительного назначения ЛГ, поскольку ЛГ-активность ЧМГ обусловлена хорионическим гонадотропином человека) (рисунок 3). В обеих группах отмечались схожие уровни прегненолона ввиду наличия единого субстрата и аналогичных начальных этапов фолликулярного стероидогенеза. Группа р-ФСГ продемонстрировала значительный прирост уровня прогестерона, начиная с шестого дня приема, в то время как в группе ЧМГ регистрировались значительно более высокие уровни андростендиона (рисунок 3). Уровни эстрадиола и эстрона по завершении стимуляции в обеих группах были аналогичны (Bosch и соавт. 2024) (рисунок 3).
Рисунок 3. Основные результаты анализа гормонального профиля в группах р-ФСГ и ЧМГ (адаптировано из Bosch и соавт. Hum Reprod 2024)
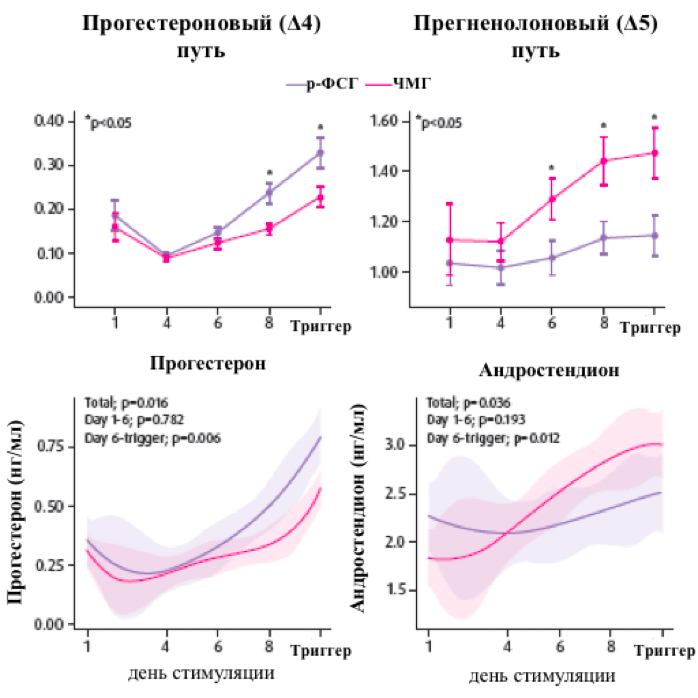
При изучении путей стероидогенеза в группе р-ФСГ была зарегистрирована повышенная конверсия прегненолона в прогестерон (превалировал прогестероновый (Δ4) путь), в то время как в группе ЧМГ преобладала конверсия прегненолона в андростендион (Δ5 путь). В целом, гормональные влияния с 1 по 6 день стимуляции были аналогичны; начиная с шестого дня до дня введения триггера в группе р-ФСГ преобладало воздействие прогестерона, в группе ЧМГ - андростендиона (Bosch и соавт. 2024) (рисунок 4).
Рисунок 4. Различия в фолликулярном стероидогенезе и воздействии прогестерона и андростендиона между группами р-ФСГ и ЧМГ (адаптировано из Bosch и соавт. Hum Reprod 2024)
Лишь в группе р-ФСГ была выявлена положительная корреляция между уровнями ФСГ и прогестерона. Подобная корреляция с мочевым ФСГ отсутствовала, что позволило впервые предположить наличие различных изоформ гонадотропинов. Корреляция между уровнями ЛГ или ХГЧ и прогестерона отсутствовала (Bosch и соавт. 2024). В группе ЧМГ при анализе фолликулярной жидкости в последней регистрировались более высокие уровни ФСГ, ЛГ, эстрадиола, тестостерона и андрогенов, в то время как уровни прогестерона в обеих группах значительно не отличались.
|
Единственным гормоном, уровень которого коррелировал с прогестероном, был ФСГ в группе р-ФСГ
|
Примечательно, что избыточный прогестерон, синтезируемый в группе р-ФСГ, не задерживался в фолликулах, а поступал в системный кровоток. Использование ЧМГ сопровождалось активизацией прегненолонового (Δ5) пути фолликулярного стероидогенеза, на конечных этапах которого андрогены ароматизируются в экстрогены. Использование р-ФСГ, напротив, потенцировало прогестероновый (Δ4) путь стероидогенеза, в ходе которого образуется прогестерон, который не накапливается в фолликуле, а поступает в кровоток.
Выводы
Таким образом,
- Фолликулярный стероидогенез при овариальной стимуляции ЧМГ и р-ФСГ различен.
- ЧМГ усиливает преобразование прегненолона в андростендион посредством Δ5 пути, в то время как р-ФСГ активирует Δ4 путь, повышая выработку прогестерона.
- Следовательно, активность ЛГ, обеспечиваемая ХГЧ-компонентом ЧМГ, приводит к более высоким уровням андрогенов и эстрадиола наряду с более низким уровнем прогестерона.
Описанный специфический гормональный профиль, по-видимому, оказывает благоприятное влияние как на компетентность ооцитов, так и на рецептивность эндометрия, что может быть особенно актуально:
- Для пациенток с высоким овариальным ответом путем модуляции роста фолликулов на гормонально-зависимой стадии через атрезию, вызываемую более высокими уровнями андрогенов;
- Для пациенток старшего репродуктивного возраста за счет восстановления оптимальной фолликулярной среды;
- Для пациенток, у которых запланирован повторный перенос эмбриона ввиду обеспечения более надежного контроля сывороточного уровня прогестерона в конце фолликулярной фазы с целью предотвращения его избыточного повышения, ассоциированного с нарушением рецептивности эндометрия.
Литература:
-
Andersen AN, Devroey P, Arce JC. Clinical outcome following stimulation with highly purified hMG or recombinant FSH in patients undergoing IVF: a randomized assessor-blind controlled trial. Hum Reprod 2006;21:3217-2
- Bosch E, Alamá P, Romero JL et al. Serum progesterone is lower in ovarian stimulation with highly purified HMG compared to recombinant FSH owing to a different regulation of follicular steroidogenesis: a randomized controlled trial. Hum Reprod 2024;39:393-402
-
Bosch E, Alviggi C, Lispi M et al. Reduced FSH and LH action: implications for medically assisted reproduction. Hum Reprod 2021;36:1469-80
-
Bosch E, Labarta E, Crespo J et al. Circulating progesterone levels and ongoing pregnancy rates in controlled ovarian stimulation cycles for in vitro fertilization: analysis of over 4000 cycles. Hum Reprod 2010;25:2092-100
-
Bosch E, Vidal C, Labarta E et al. Highly purified hMG versus recombinant FSH in ovarian hyperstimulation with GnRH antagonists - a randomized study. Hum Reprod 2008;23:2346-51
-
Casarini L, Santi D, Brigante G, Simoni M. Two hormones for one receptor: evolution, biochemistry, actions, and pathophysiology of LH an hCG. Endocr Rev 2018;39:549-92
- Davison SL, Bell R, Donath S et al. Androgen levels in adult females: changes with age, menopause, and oophorectomy. J Clin Endocrinol Metab 2005;90:3847-53
-
Devroey P, Pellicer A, Andersen AN et al. A randomized assessor-blind trial comparing highly purified hMG and recombinant FSH in a GnR antagonist cycle with compulsory single-blastocyst transfer. Fertil Steril 2012;97:561-71
-
Huang C-C, Lien Y-R, Chen H-F et al. The duration of pre-ovulatory serum progesterone elevation before hCG administration affects the outcome of IVF/ICSI cycles. Hum Reprod 2012;27:2036-45
-
Khair A, Brown T, Markert M et al. Highly Purified Human Menopausal Gonadotropin (HP-hMG) Versus Recombinant Follicle-Stimulating Hormone (rFSH) for Controlled Ovarian Stimulation in US Predicted High-Responder Patients: A Cost-Comparison Analysis. Pharmacoecon Open 2023;7:851-60
-
Klein NA, Battaglia DE, Fujimoto VY et al. Reproductive aging: accelerated ovarian follicular development associated with a monotropic follicle-stimulating hormone rise in normal older women. Clin Endocrinol Metab 1996;81:1038-45
- Santi D, Casarini L, Alviggi C, Simoni M. Efficacy of Follicle-Stimulating Hormone (FSH) Alone, FSH + Luteinizing Hormone, Human Menopausal Gonadotropin or FSH + Human Chorionic Gonadotropin on Assisted Reproductive Technology Outcomes in the “Personalized” Medicine Era: A Meta-analysis. Front Endocrinol (Lausanne) 2017;8:114
-
Smitz J, Andersen AN, Devroey P et al. Endocrine profile in serum and follicular fluid differs after ovarian stimulation with HP-hMG or recombinant FSH in IVF patients. Hum Reprod 2007;22:676-87
-
Welt CK, Jimenez Y, Sluss PM et al. Control of estradiol secretion in reproductive ageing. Hum Reprod 2006;21:2189-93
-
Witz CA, Daftary GS, Doody KJ et al. Randomized assessor-blinded trial comparing highly purified human menotropin and recombinant follicle-stimulating hormone in high responders undergoing intracytoplasmic sperm injection. Fertil Steril 2020;114:321-30
-
Zeleznik AJ. Follicle selection in primates: “many are called but few are chosen”. Biol Reprod 2001;65:655-9

 вернуться к списку
вернуться к списку



