Статьи
Персонификация лютеиновой поддержки на основании оценки уровней экспрессии эндометриальных микроРНК в лютеиновую фазу 11 октября 2024
Одной из основных причин бесплодия, преодоление которой ассоциировано со значительными трудностями ввиду не до конца изученных причин и провоцирующих факторов, служат повторные неудачи имплантации (ПНИ).
Большинством экспертов мирового репродуктологического сообщества ПНИ определяются как ненаступление клинической беременности после переноса одного или двух эмбрионов высокого качества по крайней мере в трех последовательных циклах экстракорпорального оплодотворения (ЭКО) при отсутствии каких-либо органических факторов, снижающих шансы успешной имплантации [1]. В клиническом протоколе «Вспомогательные репродуктивные технологии и искусственная инсеминация» Минздрава РФ от 2019 года подобная клиническая ситуация определяется как «Повторные неудачные попытки переноса эмбрионов (имплантации)» и охватывает случаи трех неудачных попыток селективного переноса «свежих» или размороженных эмбрионов у женщин моложе 35 лет и двух — у женщин 35 лет и старше при отсутствии каких-либо факторов, снижающих шансы наступления клинической беременности.
До недавнего времени среди причин ПНИ основное внимание уделялось патологии эмбриона [2], однако к настоящему времени после получения результатов ряда исследований на первый план вышла недостаточная рецептивность эндометрия, лежащая в основе примерно двух третей неудач имплантации [3].
Напомним, под рецептивностью понимается состояние эндометрия во время окна имплантации, т.е. короткого периода в середине лютеиновой фазы, когда эндометрий приобретает адгезивные свойства, способствующие синхронной имплантации эмбриона [4]. Долгое время считалось, что временные рамки окна имплантации постоянны у всех женщин, включая пациенток с ПНИ, в связи с чем рецептивность эндометрия в программах вспомогательных репродуктивных технологий (ВРТ) оценке не подвергалась. Позднее было доказано, что в 30% циклов ЭКО в отсутствие предварительного определения рецептивности эндометрия отмечается смещение окна имплантации, и к моменту переноса эмбриона в полость матки условия для его дальнейшего развития оказываются неоптимальными [5], в связи с чем оценки уровня рецептивности эндометрия с целью синхронизации состояния последнего со стадией развития эмбриона на основании определения активности 238 генов, ассоциированных с уровнем рецептивности слизистой оболочки матки, был разработан тест ERA (англ. Endometrial receptivity analysis), рутинное применение которого, однако, оказалось нецелесообразным [6].
Другой значимой причиной ПНИ служит неадекватный режим поддержки лютеиновой фазы в циклах переноса размороженных эмбрионов. Важнейшим изученным маркером адекватности последней служит сывороточный уровень прогестерона, измеряемый за 1-2 дня до переноса эмбриона, однако существуют значительные межиндивидуальные различия последнего на фоне одинаковых режимов приема препаратов прогестерона. Учитывая, что у пациентки может иметься своя персональная норма сывороточного прогестерона, необходимая для успешной имплантации эмбриона, многие эксперты подчеркивают необходимость дальнейшего поиска биологических маркеров, в т.ч. в тканях эндометрия, которые позволят максимально персонифицировать подбор доз препаратов прогестерона в рамках поддержки лютеиновой фазы.
В последнее время интерес привлекла возможность использования для персонификации лютеиновой поддержки микроРНК - небольших молекул, транскрибируемых с геномной ДНК. К настоящему моменту в геноме человека идентифицировано более 2500 микроРНК, которые посредством подавления экспрессии генов играют неотъемлемую роль в регуляции различных биологических процессов, включая образование половых клеток, эмбриогенез, а также являются звеньями патогенеза таких заболеваний, как эндометриоз, эндометрит и рак эндометрия [7].
Так, микроРНК miR-30b, miR-181 и miR-223-3p осуществляют контроль за циклическими изменениями эндометрия, обеспечивают его рецептивность и служат важнейшими маркерами имплантации, а срыв регуляции, опосредованный микроРНК miR-21 и miR-22, может лежать в основе развития ПНИ, влияя на ранние клеточные процессы, обеспечивающие имплантацию. Chen MJ, Hsu A, Lin PY предложили модель определения рецептивности эндометрия на основании профиля экспрессии панели микроРНК в крови пациенток, позволяющего дифференцировать статус образцов эндометрия как «пре-», «пострецептивный» или «рецептивный», при котором шанс имплантации будет максимален [8] (рисунок 1). Биопсия эндометрия проводилась спустя 120 ± 4 ч после начала вагинального введения прогестерона в дозе 800 мг в день.
Рис. 1. Тепловая карта, иллюстрирующая различия в уровне экспрессии генов, осуществляют контроль за циклическими изменениями, в пре-, пострецептивном и рецептивном эндометрии [8]
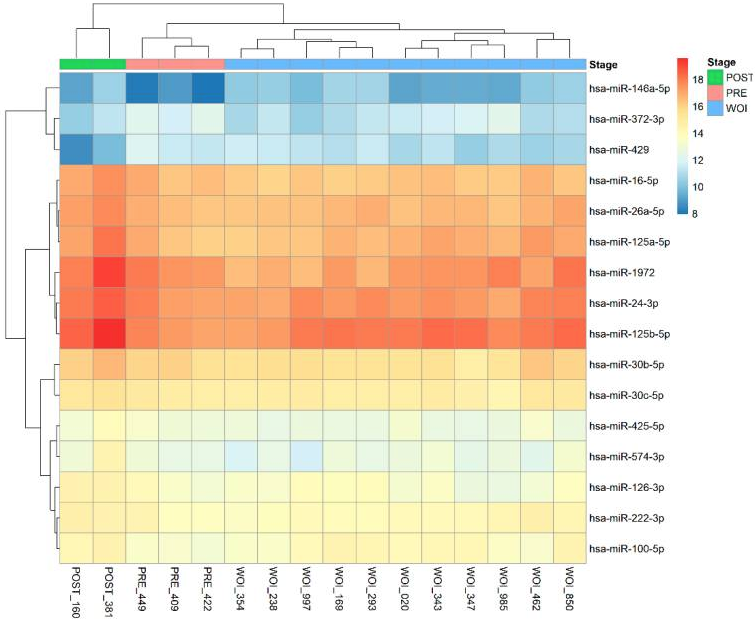
* POST – пострециптивный эндометрий; PRE – пререцептивный эндометрий; WOI – «окно имплантации». Справа представлена шкала соответствия цветовой кодировки уровню экспрессии указанных генов.
Коррекция доз гестагенов на основании статуса эндометрия позволила авторам исследования обеспечить оптимальным режимом лютеиновой поддержки весь 91% пациенток, у которых отмечалось смещение окна имплантации. Повышение доз при построении тепловых карт в динамике приводило к сдвигу профилей экспрессии микроРНК в сторону последнего, значительно повышая шансы на наступление клинической беременности.
Таким образом, определение микроРНК периферической крови в криоциклах на ЗГТ служит перспективным биомаркером для персонифицирования лютеиновой поддержки и повышения шансов достижения желанной беременности.
Список литературы:
-
Comins-Boo A., García-Segovia A., del Prado N.N. et al. Evidencebased update: immunological evaluation of recurrent implantation failure. Reprod. Immunol. Open Acc. 2016; 1(4): 24. DOI:10.4172/2476-1974.100024.
-
Hashimoto T., Koizumi M., Doshida M. et al. Efficacy of the endometrial receptivity array for repeated implantation failure in Japan: a retrospective, two-centers study. Reprod. Med. Biol. 2017; 16(3): 290–6. DOI: 10.1002/rmb2.12041.
- Shi C., Shen H., Fan L.J. et al. Endometrial microRNA signature during the window of implantation changed in patients with repeated implantation failure. Chin. Med. J. 2017; 130(5): 566–73. DOI: 10.4103/0366-6999.200550.
-
Pathare A.D.S., Zaveri K., Hinduja I. Downregulation of genes related to immune and inflammatory response in IVF implantation failure cases under controlled ovarian stimulation. Am. J. Reprod. Immunol. 2017; 78(1): e12679. DOI: 10.1111/aji.12679.
-
Ruiz-Alonso M, Valbuena D, Gomez C, Cuzzi J, Simon C. Endometrial Receptivity Analysis (ERA): Data versus Opinions. Hum Reprod Open. 2021;2021(2):hoab011.
-
Scott Jr.R.T. Endometrial receptivity screening in the general assisted reproductive technology population. Fertil. Steril. 2021; 115: 895-896.
-
Аушев В.Н. МикроРНК: малые молекулы с большим значением. Клин. онкогематол. 2015; 8(1): 1–12.
-
Chen M.J., Hsu A., Lin P.Y. et al. Development of a Predictive Model for Optimization of Embryo Transfer Timing Using Blood-Based microRNA Expression Profile. Int. J. Mol. Sci. 2023; 25(1): 76. doi: 10.3390/ijms25010076.

 вернуться к списку
вернуться к списку



