Статьи
Рационализация продолжительности применения препаратов лютеиновой поддержки (пролютекса) в программах ВРТ 20 декабря 2023
Согласно результатам крупного опроса, охватившего 303 отделения вспомогательных репродуктивных технологий (ВРТ), проводящих в среднем 231 000 циклов ЭКО в год, препараты лютеиновой поддержки отменяют в период с 8 по 12 неделю беременности [1]. Хотя убедительные доказательства целесообразности пролонгированного назначения препаратов лютеиновой поддержки отсутствует, согласно данным глобального веб-опроса, охватившего 35 стран, проводящих в общей сложности 51 155 циклов ЭКО в год, в 67% всех циклов препараты прогестерона отменяли лишь на 12 неделе гестации, в 22% - при обнаружении сердцебиения плода по данным УЗИ, в 12% - при получении положительного результата теста на беременность [2]. В действующих клинических рекомендациях по ряду акушерских состояний, которые с 2024 г. станут основой для оценки качества оказания медицинской помощи, также отмечается ряд разночтений по поводу сроков назначения препаратов прогестерона. Так, в наиболее профильных клинических рекомендациях по женскому бесплодию от 2021 г. указано, что длительность их применения зависит от особенностей течения беременности и анамнеза пациентка и обычно пролонгируется до 12 недель беременности [3]. В клинических рекомендациях по нормальной беременности от 2020 г., как и в КР по привычному выкидышу от 2022 г., длительность приема гестагенов пациентками из группы высокого риска ограничивается 20 неделями, при этом, в случае высокого риска преждевременны родов, рекомендовано дополнительное назначение последних с 22 по 34 недели беременности [4, 5]. Согласно КР по истмико-цервикальной недостаточности от 2021 г., с целью уменьшения риска выкидыша и преждевременных родов препараты прогестерона должны назначаться до 34 недель [6]. Действительно, прогестерон может оказывать профилактическое действие в отношении самопроизвольного выкидыша и преждевременных родов как благодаря его экстраэндометриальным иммунологическим эффектам, так и, собственно, миорелаксантному действию [7, 8]. Итак, рассмотрев возможные сроки применения препаратов прогестерона, перейдем к анализу данных литературы, касающихся рационализации длительности их применения в программах ВРТ при неосложненной беременности.
Как известно, оптимальная сывороточная концентрация прогестерона (>30 нмоль/л [9]) крайне важна для обеспечения процессов имплантации и пролонгирования беременности [7, 8]. Необходимость экзогенной поддержки лютеиновой фазы в стимулированных циклах объясняется недостаточностью последней на фоне исходно повышенной выработкой прогестерона множеством образующихся желтых тел, что снижает выработку лютеинизирующего гормона по механизму отрицательной обратной связи, а также в результате десенсибилизации гипофиза агонистами ГнРГ. В циклах ЭКО на заместительной гормональной терапии (ЗГТ) желтое тело вовсе отсутствует, в связи с чем экзогенный путь введения прогестерона служит единственным источником последнего. В случае успешной имплантации и наступления клинической беременности к началу 3-его месяца происходит лютео-плацентарный сдвиг - функцию синтеза прогестерона берет на себя плацента, и потребность в экзогенном введении гормона исчезает.
К настоящему времени проведено немало исследований, направленных на определение точных сроков лютео-плацентарного сдвига. В 1990 году Devroey и соавт. сообщили о значительном росте прогестерона к 9 неделе беременности [10], а спустя год Scott и соавт. в ходе исследования аналогичного дизайна отметили проградиентный активный прирост сывороточной концентрации прогестерона, начиная с 7 недели беременности [11]. В 2019 г. Friis Petersen J. и соавт. вновь провели проспективное когортное исследование, направленное на оценку динамики изменения уровней основных гормонов в сыворотке крови на ранних сроках беременности (рис. 1) [12].
Рис. 1. Динамики изменения сывороточной концентрации прогестерона на ранних сроках беременности [12]
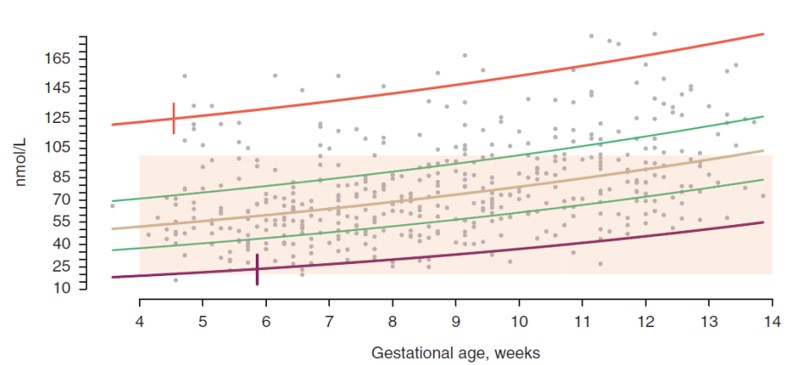
Результаты исследования показали, что сывороточная концентрация прогестерона линейно возрастает, достигая оптимальной для поддержания беременности к 6 неделе гестации.
Liu X-R. и соавт. провели систематический обзор и метаанализ, включивший 6 исследований с общим числом участниц, равным 1202, в котором обобщили данные о сроках отмены препаратов прогестерона и репродуктивные исходы (табл. 1) [13].
Таблица 1. Основные параметры исследований, включенных в систематический обзор и метаанализ [13]
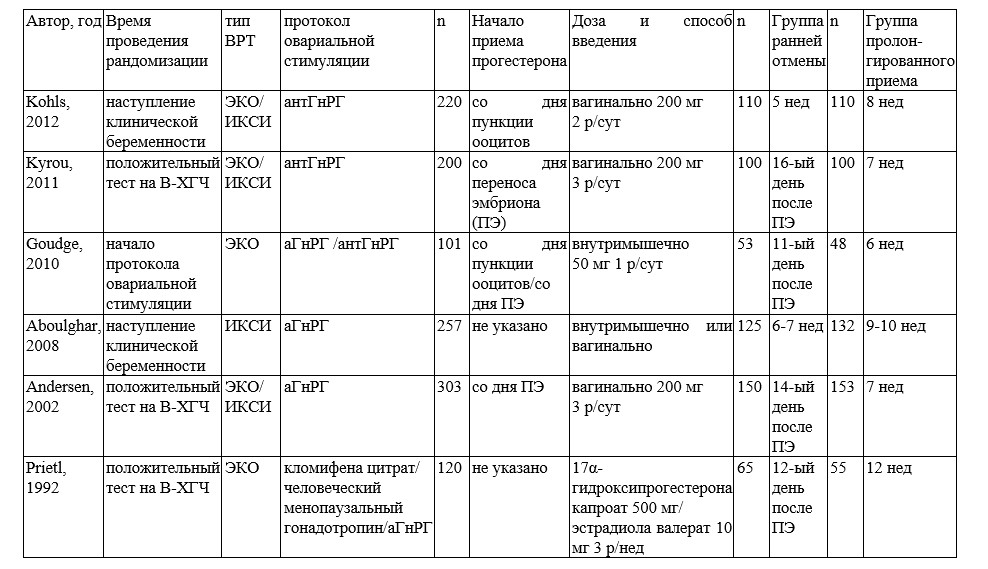
Статистически значимых различий в уровнях родов живым плодом (ОР: 0,95, 95% ДИ: 0,86–1,05), невынашивания беременности (ОР: 1,01, 95% ДИ: 0,74–1,38) или наступления клинической беременности (ОР: 0,97, 95% ДИ: 0,90–1,05) среди групп ранней и поздней отмены препаратов прогестерона даже после проведения анализа чувствительности обнаружено не было.
В ходе недавнего статистического обзора и метаанализа, включившего 94 рандомизированных контролируемых исследования (РКИ), в которых сравнивались различные схемы поддержки лютеиновой фазы среди 26 198 пациенток не было выявлено достоверных различий в показателях наступления клинической беременности и родов живым плодом между группами ранней отмены (на 14-ый день после ПЭ) и пролонгированного приема (до 12 недель) препаратов прогестерона [14]. Аналогичные результаты были получены при анализе 156 «свежих» циклов ЭКО/ИКСИ у пациенток с «бедным» овариальным ответом, диагностированным по Болонским критериям [15].
В целом, к настоящему моменты опубликованы данные о возможности отмены препаратов лютеиновой поддержки после положительного теста на B-ХГЧ [15, 16] и после регистрации при УЗИ сердцебиения плода [17] ввиду отсутствия целесообразности продолжения их приема в отсутствие показаний.
Появляется все больше данных о возможности персонализации сроков отмены препаратов прогестерона. Еще в 2005 г. Ioannidis и соавт. продемонстрировали, что сывороточная концентрация прогестерона, измеренная на 14-ый день после пункции ооцитов, с высокой степенью вероятности позволяет отличить жизнеспособную беременность от аномальной (внематочной, биохимической, самопроизвольного выкидыша), т.е. спрогнозировать репродуктивный исход (площадь под фармакокинетической кривой = 0,927, 95% ДИ = 0,89-0,96; р < 0,0001) [18]. Позднее, основываясь на этих данных, Segal L. и соавт. провели ретроспективное когортное исследование, включившее 180 циклов ЭКО и ИКСИ и пришли к следующему выводу: установление сывороточных концентраций прогестерона на уровне ≥ 110 нмоль/л, что значительно превышает приведенный выше пороговый уровень сывороточного прогестерона, необходимый для поддержания беременности, и эстрадиола на уровне ≥ 1000 пмоль/л через 14 дней после пункции ооцитов (в день теста на беременность) достоверно свидетельствует о нормализации эндогенной выработки прогестерона и может служить надежным критерием отмены экзогенных форм последнего [19]. В свежем ретроспективном анализе необходимый пороговый уровень прогестерона был еще более конкретизирован. Duport Percier M. и соавт. провели моноцентрическое ретроспективное исследование, которое включило 99 протоколов контролируемой овариальной стимуляции хорионическим гонадотропином человека с последующим переносом свежего эмбриона и стандартным режимом поддержки лютеиновой фазы в виде микронизированного вагинального прогестерона в дозе 600 мг 1 р/сут в течение 15 дней [20]. Полученные данные позволили сделать исследователям заключить: очень низкий сывороточный уровень прогестерона в день положительного результата теста на беременность (<10 нг/мл) свидетельствует об очевидной лютеиновой недостаточности и подозрителен в отношении нарушения абсорбции вагинальных форм; низкий сывороточный уровень прогестерона (10 нг/мл < Р4 < 16,5 нг/мл) говорит о возможной лютеиновой недостаточности и/или нарушении абсорбции вагинального прогестерона; высокий сывороточный уровень (≥16,5 нг/мл) является поводом для отмены препаратов лютеиновой поддержки ввиду отсутствия потребности в последней.
Резюмируя все вышесказанное можно подытожить, что сочетанную терапию препаратами прогестерона с добавлением подкожных инъекций, обеспечивающих стабильную концентрацию последнего и наилучшие репродуктивные исходы, следует продолжать до 7-8 недель беременности. Серьезным ограничивающим фактором всех упомянутых выше исследований является их ретроспективный характер. Дальнейшее проведение проспективных РКИ с большим объемом выборки позволит подтвердить полученные данные и выработать наиболее рациональную стратегию назначения препаратов лютеиновой поддержки.
Литература:
1. Shoham G, Leong M, Weissman A. A 10-year follow-up on the practice of luteal phase support using worldwide web-based surveys. Reprod Biol Endocrinol. 2021;26;19(1):15.
2. Vaisbuch E, Leong M, Shoham Z. Progesterone support in IVF: is evidence-based medicine translated to clinical practice? a worldwide web-based survey. Reprod BioMed Online (2012) 25:139–45.
3. Российское общество акушеров-гинекологов, Российская ассоциация репродукции человека. Женское бесплодие. Клинические рекомендации. 2021; 81 с.
4. Российское общество акушеров-гинекологов. Нормальная беременность. Клинические рекомендации. 2020; 80 с.
5. Российское общество акушеров-гинекологов. Привычный выкидыш. Клинические рекомендации. 2022; 56 с.
6. Российское общество акушеров-гинекологов. Истмико-цервикальная недостаточность. Клинические рекомендации. 2021; 54 с.
7. Di Renzo GC, Giardina I, Clerici G, Brillo E, Gerli S. Progesterone in normal and pathological pregnancy. Horm Mol Biol Clin Investig. 2016;27:35–48.
8. Csapo AI, Pulkkinen M. Indispensability of the human corpus luteum in the maintenance of early pregnancy Luteectomy evidence. Obstet Gynecol Surv. 1978;33:69–81.
9. Kohls G, Ruiz F, Martinez M, Hauzman E, de la Fuente G, Pellicer A, Garcia-Velasco JA. Early progesterone cessation after in vitro fertilization/intracytoplasmic sperm injection: a randomized, controlled trial. Fertil. Steril. 2012; 98: 858-862.
10. Devroey P, Camus M, Palermo G, Smitz J, Van Waesberghe L, Wisanto A, et al. Placental production of estradiol and progesterone after oocyte donation in patients with primary ovarian failure. Am J Obstet Gynecol 1990;162:66–70.
11. Scott R, Navot D, Liu HC, Rosenwaks Z. A human in vivo model for the luteoplacental shift. Fertil Steril. 1991;56:481–4.
12. Petersen F, et al. Early pregnancy reference intervals; 29 serum analytes from 4 to 12 weeks' gestation in naturally conceived and uncomplicated pregnancies resulting in live births. Clin Chem Lab Med. 2019;57(12):1956-1967.
13. Liu X-R, Mu H-Q, Shi Q, Xiao X-Q, Qi H-B. The optimal duration of progesterone supplementation in pregnant women after IVF/ICSI: a meta-analysis. Reprod Biol Endocrinol RBE. 2012;10:107.
14. Van der Linden, M.; Buckingham, K.; Farquhar, C.; Kremer, J.A.; Metwally, M. Luteal Phase Support for Assisted Reproduction Cycles. Cochrane. Database Syst. Rev. 2015;CD009154.
15. Pan S-P, Chao K-H, Huang C-C, Wu M-Y, Chen M-J, Chang C-H, et al. Early stop of progesterone supplementation after confirmation of pregnancy in IVF/ICSI fresh embryo transfer cycles of poor responders does not affect pregnancy outcome. PLOS ONE. 2018;13(8):e0201824.
16. Tryde Schmidt KL, Ziebe S, Popovic B, Lindhard A, Loft A, Nyboe AA. Progesterone supplementation during early gestation after in vitro fertilization has no effect on the delivery rate. Fertil Steril. 2001;75:337–341.
17. Aboulghar MMA, Amin YM, Al-Inany HG, Aboulghar MMA, Mourad LM, Serour GI, et al. Prospective randomized study comparing luteal phase support for ICSI patients up to the first ultrasound compared with an additional three weeks. Hum Reprod. 2008;23:857–862.
18. Ioannidis G, Sacks G, Reddy N, Seyani L, Margara R, Lavery S, Trew G. Day 14 maternal serum progesterone levels predict pregnancy outcome in IVF/ICSI treatment cycles: a prospective study. Hum. Reprod. 2005;20:741-746.
19. Segal L, Breyzman T, Kol S. Luteal phase support post IVF: individualized early stop. Reprod BioMed Online. 2015;31:633–7.
20. Duport Percier M, Brouillet S, Mollevi C, Duraes M, Anahory T, Ranisavljevic N. Serum progesterone concentration on pregnancy test day might predict ongoing pregnancy after controlled ovarian stimulation and fresh embryo transfer. Front Endocrinol (Lausanne). 2023;14:1191648.

 вернуться к списку
вернуться к списку



