Статьи
Сравнение эффективности подкожной и вагинальной форм прогестерона с использованием «протокола спасения» в циклах переноса размороженных бластоцист 12 декабря 2023
Ключевые положения
В целом, 15,8% пациенткам из группы введения вагинального прогестерона в виде геля требовалось дополнительное введение прогестерона для обеспечения уровня прогестерона сыворотки крови > 8,75 нг/мл; напротив, ни одной из пациенток в группе двукратного подкожного (п/к) введения прогестерона дополнительный прием прогестерона не потребовался. Частота продолжающейся беременности была аналогична в группах применения п/к формы без дополнительного введения прогестерона и вагинальной формы с применением внеочередной дозы прогестерона в рамках «протокола спасения».
Резюме
Вопрос исследования: обеспечивает ли п/к введение прогестерона частоту продолжающейся беременности, аналогичную таковой при применении вагинального прогестерона и протокола спасения в циклах заместительной гормональной терапии (ЗГТ) и переноса размороженных эмбрионов?
Дизайн исследования: ретроспективное когортное исследование. Сопоставлялись 2 группы: группа интравагинального введения геля с прогестероном (декабрь 2019 г. - октябрь 2021 г.; n = 474) и группа подкожного введения прогестерона (ноябрь 2021 г. - ноябрь 2022 г.; n = 249). После введения эстрогена вводили вагинальный гель с прогестероном по 90 мг 2 р/сут и п/к прогестерон по 25 мг два р/сут соответственно. Уровень прогестерона в сыворотке крови измеряли за 1 день до переноса размороженной бластоцисты (т.е. на 5-й день введения прогестерона). Пациенткам с концентрацией сывороточного прогестерона < 8,75 нг/мл добавляли подкожную инъекцию 25 мг прогестерона в рамках «протокола спасения».
Результаты: В группе вагинального прогестерона у 15,8% пациенток сывороточный уровень прогестерона за день до ПЭ был < 8,75 нг/мл, в связи с чем им назначался «протокол спасения», в то время как ни одной пациентке из группы подкожного введения подобная мера не потребовалась. Частота продолжающейся беременности, уровни биохимической и клинической беременностей в группах применения п/к формы без дополнительного введения прогестерона и вагинальной формы с применением «протокола спасения» были сопоставимы. При условии применения в группе вагинального прогестерона «протокола спасения» способ введения прогестерона значимым предиктором продолжающейся беременности не являлся. Влияние различных концентраций сывороточного прогестерона на репродуктивные исходы оценивалось по процентилям (< 10-го, 10-49-го, 50-90-го и > 90-го процентилей), показатели выше > 90-го процентиль составили контрольную подгруппу. В обеих исследуемых группах все процентильные подгруппы сывороточного прогестерона имели сходные показателя уровней продолжающейся беременности.
Выводы: Введение подкожной формы прогестерона в дозе 25 мг 2 р/сут поддерживает сывороточный уровень прогестерона > 8,75 нг/мл, в то время как 15,8% пациенткам из группы вагинального введения потребовалось применение «протокола спасения». В случае использования последнего уровни продолжающейся беременности в группах вагинальной и подкожной форм прогестерона сопоставимы.
Введение
Появление за последнее десятилетие эффективных и безопасных методов витрификации наряду с увеличением количества сегментированных циклов привело к значительному росту числа криоциклов во всем мире (De Geyter и соавт., 2020; Roque и соавт., 2019b). Наряду с этим, оптимальный протокол подготовки эндометрия (экстрогенного и/или андрогенного прайминга) для обеспечения наиболее благоприятных исходов в криоциклах все еще остается предметом дискуссии (Mumusoglu и соавт., 2021). Несмотря на то, что в последнее время появляется все больше данных о неблагоприятных акушерских и неонатальных последствиях использования протоколов ЗГТ, последние до сих пор наиболее часто используются для подготовки эндометрия при переносе размороженных эмбрионов у пациенток как с, так и без овуляции (Noble и Child, 2022).
Поскольку в циклах на ЗГТ желтое тело отсутствует, получение прогестерона возможно лишь экзогенным путем в виде вагинальной, внутримышечной, подкожной, пероральной и ректальной форм. В Европе наиболее часто используется вагинальный прогестерон, в то время как в США предпочтение отдается внутримышечным инъекциям. Недавно на фармацевтическом рынке появился п/к прогестерон, в связи с чем было проведено четыре исследования использования последнего в циклах на ЗГТ, согласно результатам которых данная форма обеспечивает репродуктивные исходы, аналогичные применению вагинальной (Aflatoonian и Mohammadi, 2021; Turkgeldi и соавт., 2020) или внутримышечной (Boynukalin и соавт., 2023; Turgut и соавт., 2020).
На сегодняшний день ни в одном рандомизированном контролируемом исследовании (РКИ) не проводилась сравнительная оценка влияния различных режимов дозирования п/к прогестерона на репродуктивные исходы; из 4-х опубликованных исследований, сравнивающих п/к и вагинальные (Aflatoonian и Mohammadi, 2021; Turkgeldi et al., 2020) или внутримышечные формы прогестерона (Boynukalin и соавт., 2023; Turgut и соавт., 2020), в 3-х использовалась доза 25 мг 2 р/сут (Boynukalin и соавт., 2023; Turgut и соавт., 2020; Turkgeldi и соавт., 2020), в 1-ом - доза 25 мг 1 р/сут (Aflatoonian и Mohammadi, 2021).
Благоприятное воздействие прогестерона на эндометрий, обеспечиваемое подбором оптимальной дозы и сроков введения последнего, имеет решающее значение для наступления беременности и ее пролонгирования. Теоретически измерение уровня прогестерона в эндометрии могло бы служить наиболее приемлимым методом оценки оптимальности воздействия прогестерона на эндометрий; однако, пока это не представляется возможным в рутинной клинической практике. Таким образом, в настоящий момент лишь определение концентрации прогестерона в сыворотке крови, зависящей от способа введения последнего, позволяет судить о концентрации прогестерона в эндометрии (Young et al., 2017), хотя, согласно результатам 2-х исследований, корреляция между концентрациями прогестерона в сыворотке крови и эндометрии отсутствует (Labarta и соавт., 2021; Miles и соавт., 1994).
По-видимому, имеются значительные межличностные различия в необходимой концентрации циркулирующего прогестерона для обеспечения оптимальных репродуктивных исходов, поскольку последние значительно различаются, несмотря на перенос высококачественных эмбрионов на фоне приема одинаковых доз одних и тех же форм прогестерона (Melo и соавт., 2021; Polat и соавт., 2020; Ranisavljevic и соавт., 2022). Хотя выборки в проведенных исследованиях неоднородны с позиций популяции, способа, формы и дозы введения экзогенного прогестерона, стадии развития эмбриона на момент переноса и дня забора крови на анализ сывороточного уровня прогестерона, имеются данные о лучших репродуктивных исходах при превышении концентрации прогестерона сыворотки крови определенного порога (Melo и соавт., 2021), установленного для вагинальной (Melo и соавт., 2021; Mumusoglu и соавт., 2021), внутримышечной (Boynukalin и соавт., 2019; Brady и соавт., 2014; Kofinas и соавт., 2015) и пероральной (Neumann и соавт., 2022) форм. По сведениям авторам, на сегодняшний день опубликовано лишь одно исследование, посвященное применению п/к прогестерона в криоциклах на ЗГТ, в котором сообщалось о сопоставимых показателях продолжающейся беременности у пациенток 4-х подгрупп различных квартилей (интервалов) сывороточной концентрации прогестерона (Boynukalin и соавт., 2023).
Целями данного исследования, включившего криоциклы на ЗГТ, служили сравнительная оценка эффективности п/к и вагинальной форм прогестерона с использованием, при необходимости, «протокола спасения» с определением сывороточной концентрации прогестерона в середине лютеиновой фазы, определение наличия порогового уровня сывороточного прогестерона при п/к введении, недостижение или превышение которого может оказывать негативное влияние на частоту продолжающейся беременности.
Материалы и методы
Критерии включения и исключения
Данное ретроспективное когортное исследование проводилось с декабря 2019 года по ноябрь 2022 года и включило в общей сложности 723 последовательных криоцикла переноса размороженных бластоцист 5-го или 6-го дня развития. Критерии включения: возраст женщины 44 года, индекс массы тела (ИМТ) 40 кг/м2 и наличие размороженных бластоцист 5-го или 6-го дня развития. Также были включены циклы с проведением предимплантационного генетического тестирования на анеуплоидии (ниПГТ-А), назначаемого, в основном, пациенткам старшего репродуктивного возраста (38 лет). В исследование включали лишь первый цикл криопереноса, выполненный специалистами Анатолийского центра ЭКО и женского здоровья, однако, не исключено, что у некоторых пациенток были неудачные попытки ЭКО с ПЭ в других медицинских учреждениях. Критерии исключения: циклы криопереноса с проведением ПГТ моногенных заболеваний (ПГТ-М) или ПГТ структурных перестроек в отдельных хромосомах (ПГТ-), а также наличие аномалий развития матки.
Прайминг эндометрия
Всем пациенткам проводилась подготовка эндометрия путем назначения ЗГТ в отсутствие добавления аГнРГ с целью обеспечения овариальной супрессии, как это было описано ранее (Polat и соавт., 2020). Эстрогены (Эстрофем; Ново Нордиск, Стамбул, Турция) назначались на 2-ой или 3-ий дни менструального цикла в дозе 6 мг/сут. Через 12-14 дней после начала приема эстрогенов проводилось ТВ-УЗИ для определения толщины эндометрия. Как только толщина двухслойного эндометрия достигала 7 мм, пациенткам назначался экзогенный прогестерон.
Поддержка лютеиновой фазы
В период с декабря 2019 г. по октябрь 2021 г. (n=474) с целью поддержки лютеиновой фазы применялся вагинальный гель с прогестероном в дозе 90 мг (Крайнон 8%; Merck Serono, Дармштадт, Германия). С ноябрь 2021 г. по ноябрь 2022 г. (n=249), ввиду отсутствия поставок в Турцию данного геля, с указанной целью использовался п/к прогестерон в дозе 25 мг (Пролютекс; IBSA, Лугано, Швейцария).
Перенос эмбрионов назначался на 6-й день приема препаратов прогестерона; поддержку лютеиновой фазы пролонгировали до 10-й недели беременности в циклах наступления клинической беременности.
Определение сывороточного прогестерона в криоциклах на ЗГТ и «протокол спасения» при использовании вагинальной формы
Для анализа сывороточной концентрации прогестерона забор крови у всех пациенток осуществлялся на 5-й день использования вагинального прогестерона, т.е. за 1 день до переноса размороженной бластоцисты. Все измерения были стандартизованы: анализ крови назначали на 12:00-13:00, через 4-5 часов после утреннего (08:00) введения вагинального или п/к прогестерона. Уровень сывороточного прогестерона определяли с помощью прибора VIDAS - автоматической настольной иммуноферментной системы на основе иммуноферментного флуоресцентного анализа (BioMerieux, Марси л'Этуаль, Франция), чувствительность которого для сывороточного прогестерона составляла 0,25 нг/мл. Коэффициенты вариации внутри анализа и между анализами составили 3,97 (14,30%) и 3,10 (24,30%) соответственно.
При недостижении оптимальной концентрации сывороточного прогестерона (< 8,75 нг/мл, Polat и соавт., 2020) применялся «протокол спасения», о котором сообщалось в недавнем исследовании (Yarali и соавт., 2021). Пороговый уровень сывороточного прогестерона, равный 8,75 нг/мл, соответствовал 10-му процентилю у тех пациенток, которые использовали вагинальный гель с прогестероном 2 р/сут (Polat и соавт., 2020). В рамках «протокола спасения» в группе вагинального прогестерона к описанному выше режиму введения геля добавлялись п/к инъекции прогестерона в дозе 25 мг в сутки (Пролютекс; IBSA), назначаемые во второй половине дня за сутки до ПЭ. В день ПЭ п/к прогестерон вводился с 08:00 до 09:00 часов вместе с утренней дозой вагинального геля. При данном сценарии концентрация сывороточного прогестерона дополнительно измерялась непосредственно перед переносом эмбриона (ПЭ). Поддержка лютеиновой фазы, включая применение вагинального геля с прогестероном в дозе 90 мг 2 р/сут, п/к прогестерона в дозе 25 мг 1 р/сут в сутки и пероральный прием эстрогенов, осуществлялась до 10-й недели беременности включительно в циклах наступления клинической беременности.
В случае необходимости применения «протокола спасения» в группе п/к прогестерона дополнительная болюсная инъекция прогестерона была бы назначена на вторую половину дня, когда был обнаружен низкий сывороточный уровень прогестерона (за сутки до ПЭ). Впоследствии в случае наступления клинической беременности п/к прогестерон должен был вводиться в дозе 25 мг 3 р/сут до 10-й недели беременности включительно.
Клинические и лабораторные процедуры
Стимуляция яичников, индукция финального созревания ооцитов, их извлечение, культивирование эмбрионов, витрификация, размораживание и перенос последних проводились в соответствии со стандартными протоколами, описанными ранее (Mumusoglu и соавт., 2017). Неселективная криоконсервация ооцитов осуществлялась при чрезмерном ответе яичников на стимуляцию (19 фолликулов диаметром 11 мм в день введения триггера) (Griesinger и соавт., 2016), концентрации сывороточного прогестерона > 1,5 нг/мл в день введения триггера (Venetis и соавт., 2013), отсроченной бластуляции (Franasiak и соавт., 2018; Wirleitner и соавт., 2016), наличии полипа эндометрия, серозометры или проведении ПГТ-А. Витрификацию осуществляли на 5-й или 6-й день в зависимости от стадии эмбрионального развития.
Бластоцисты классифицировали на основании их морфологии, которую оценивали в соответствии с классификацией Гарднера и Скулкрафта (Gardner and Schoolcraft, 1999).
Так, последние в соответствие с их морфологическими характеристиками были разделены на четыре группы: отличного (≥3AA), хорошего (3-6AB, 3-6BA, 1-2AA), среднего (3-6BB, 3-6AC, 3-6CA, 1-2AB, 1-2BA) и низкого качества (1-6BC, 1-6CB,1-6СС, 1-2BB). Пациенткам переносили 1 или 2 бластоцисты. В последнем случае в анализ включалась та, что имела наилучшие морфологические характеристики.
Определения конечных результатов
Первичной конечной точкой исследования служила частота продолжающейся беременности, определяемой по визуализации эмбриона с сердцебиением на 8 неделе беременности. Положительный тест на беременность определялся как концентрация бета-хорионического гонадотропина человека (бета-ХГЧ) в сыворотке крови > 20 МЕ/л при проведении последнего спустя 9 дней после переноса размороженной бластоцисты. Клиническая беременность устанавливалась при визуализации эмбриона при ТВ-УЗИ и/или документировании наличия ткани трофобласта в макропрепарате, полученном после выкидыша. Биохимическая беременность определялась как прерывание беременности при эпизоде определения сывороточной концентрации бета-ХГЧ > 20 МЕ/л в отсутствие визуализации плодного яйца при УЗИ ОМТ. Выкидыш характеризовался как самопроизвольная потеря клинической беременности на сроке до 12 недель, исключая случаи биохимической беременности. Общий уровень потерь беременности рассчитывался как сумма биохимических беременностей и потерь клинических беременностей.
Протокол исследования утвержден институциональным наблюдательным советом (29.12.2022-52763).
Статистический анализ данных
Для анализа использовался статистический пакет для гуманитарных наук версии 23.0 (IBM Corp., Армонк, Нью-Йорк, США) и R версии 3.6.1 (https://www.rproject.org/).
Значение p, равное 0,05, представляет собой порог статистической значимости.
Результаты
Исходные демографические характеристики групп вагинального и п/к прогестерона приведены в таблице 1. Средний возраст и ИМТ были значительно выше в группе п/к прогестерона в сравнении с группой вагинального прогестерона (32,9 ± 5,2 vs 32,0 ± 5,2 года, р = 0,025; 26,1 ± 4,9 vs 25,3 ± 4,4 кг/м2, р = 0,033 соответственно) (таблица 1). Частота циклов неселективной витрификации ооцитов, напротив, в группе п/к прогестерон была значительно ниже (49,8% vs 61,2%; р = 0,003). Наконец, количество перенесенных бластоцист было значительно выше при использовании п/к прогестерона (р < 0,001) (таблица 1). Средние концентрации сывороточного прогестерона в криоциклах на ЗГТ составили 26,1 ± 8,1 нг/мл и 13,8 ± 5,5 нг/мл в группах п/к и вагинального прогестерона соответственно (р < 0,001). Диапазоны сывороточных концентраций прогестерона в данных группах составили 11,60-57,12 нг/мл и 4,27-35,94 нг/мл соответственно. В группе применения вагинального геля с прогестероном у 15,8% пациенток сывороточный уровень прогестерона за сутки до ПЭ был ниже 8,75 нг/мл, в связи с чем им проводился «протокол спасения», после чего последний в день ПЭ в среднем составлял 32,12 нг/мл (диапазон: 14,36-48,75 нг/мл). У всех пациенток из группы п/к прогестерона сывороточная концентрация прогестерона за сутки до ПЭ превышала пороговый уровень, равный 8,75 нг/мл. Толщина двухслойного эндометрия в день начала приема прогестерона была сопоставима между двумя исследуемыми группами. Также были сопоставимы все нескорректированные показатели репродуктивных исходов, включая положительный тест на беременность при ПЭ, частоту наступления клинической беременности, биохимических беременностей, невынашивания беременности и продолжающейся беременности (таблица 1).
Таблица 1. Сравнение демографических особенностей, характеристик цикла и репродуктивных исходов среди пациенток, получавших п/к и вагинальный прогестерон в криоциклах на ЗГТ
Логистическая регрессия
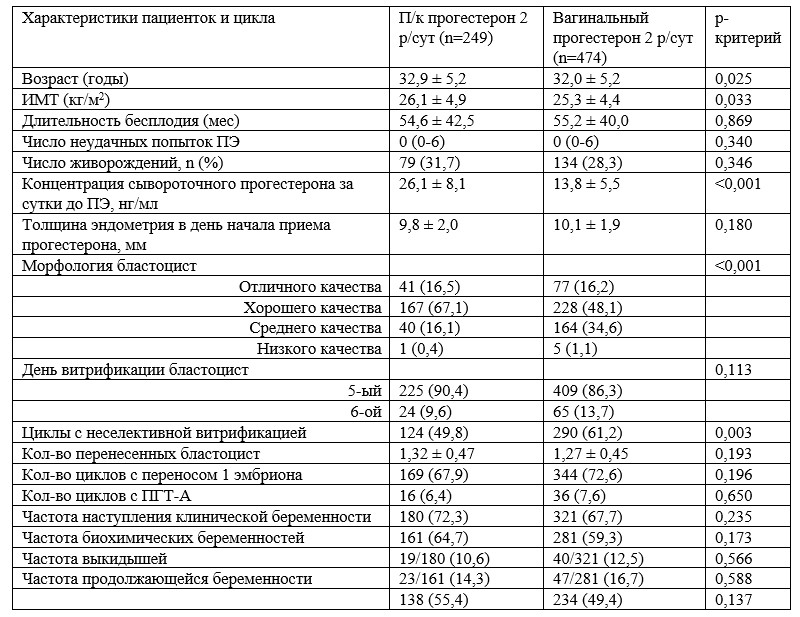
С целью выявления статистически значимых независимых предикторов продолжающейся беременности применялась логистическая регрессия (таблица 2). При сравнении групп вагинального (с «протоколом спасения» и без него) и п/к прогестерона лишь возраст (ОШ 0,949, 95% ДИ: 0,915-0,983; р = 0,004), ИМТ (ОШ 0,953, 95% ДИ: 0,920-0,998; р = 0,008), количество перенесенных бластоцист (ОШ 2,177, 95% ДИ: 1,450-3,269; р < 0,001), морфология бластоцист (среднего качества в сравнении с отличным; ОШ 0,382, 95% ДИ: 0,228-0,642; р < 0,001) и проведение ПГТ-A (ОШ 2,017, 95% ДИ: 1,017-3,999; р = 0,045) служили значимыми предикторами продолжающейся беременности (таблица 2).
Таблица 2. Логистический регрессионный анализ с целью выявления независимых предикторов продолжающейся беременности
Процентили сывороточного прогестерона и репродуктивные исходы
Как в группе вагинального, так и п/к прогестерона, влияние различных концентраций последнего в сыворотке крови на репродуктивные исходы оценивалось по процентилям (< 10-го, 10-49-го, 50-90-го и > 90-го процентилей), при этом интервал показателей > 90-го процентиля был принят в качестве контрольной подгруппы. Корректировка проводилась с учетом возраста пациенток, ИМТ, наличия родов в анамнезе, количества перенесенных бластоцист, стадии эмбрионального развития, на которой производилась витрификации эмбриона, применения неселективной витрификации, ПГТ-А, морфологических характеристик бластоцист, толщины эндометрия, продолжительности бесплодия и количества предыдущих попыток ПЭ.
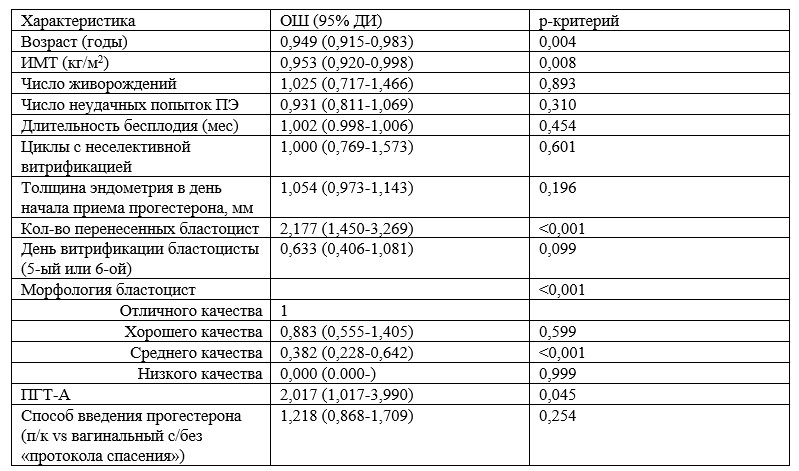
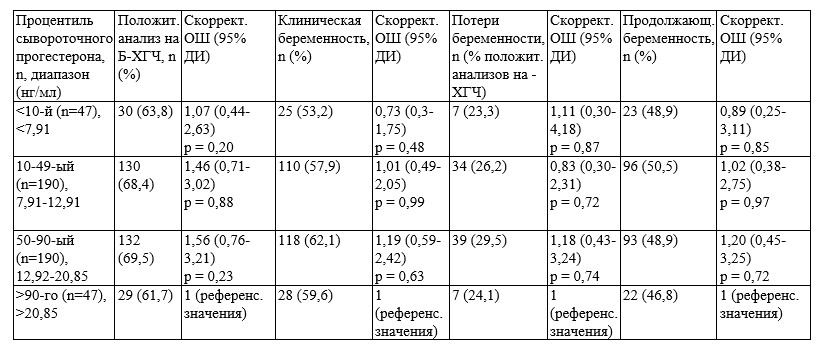
В группе п/к прогестерона пороговое значение сывороточной концентрации прогестерона для 10-го процентиля составило 16,40 нг/мл (n=24) (таблица 3). Все скорректированные показатели репродуктивных исходов, включая положительный тест на В-ХГЧ, частоту продолжающейся беременности, общую частоту потерь беременности и частоту продолжающейся беременности в подгруппе <10-го процентиля были сопоставимы с таковыми контрольной подгруппы (>90-го процентиля; пороговое значение 39,05 нг/мл) (таблица 3). Остальные подгруппы, включающие показатели 10-49-го, 50-90-го и > 90-го процентилей, также имели сопоставимые с контрольной подгруппой репродуктивные исходы. Единственным исключением была частота продолжающейся беременности в подгруппе 50-90-го процентиля, которая значительно превышала аналогичный показатель подгруппы >90-го процентиля (скорректированное ОШ 2,84, 95% ДИ: 1,03-7,80; р = 0,04). Скорректированный показатель частоты продолжающейся беременности во всех подгруппах был сопоставим (рис. 1).
В группе вагинального прогестерона, где был применен протокол спасения (75 пациенток; 15,8%), все скорректированные показатели репродуктивных исходов, включая частоту продолжающейся беременности, были сопоставимы среди подгрупп <10-го, 10-49-го, 50-90-го и >90-го процентиля (таблица 4) (рис. 1).
Таблица 3. Скорректированные показатели репродуктивных исходов у пациенток (n=249) в соответствии с процентилями сывороточного прогестерона, измеренного за 1 день до ПЭ в криоциклах на ЗГТ с использованием п/к прогестерона в дозе 25 мг 2 р/сут
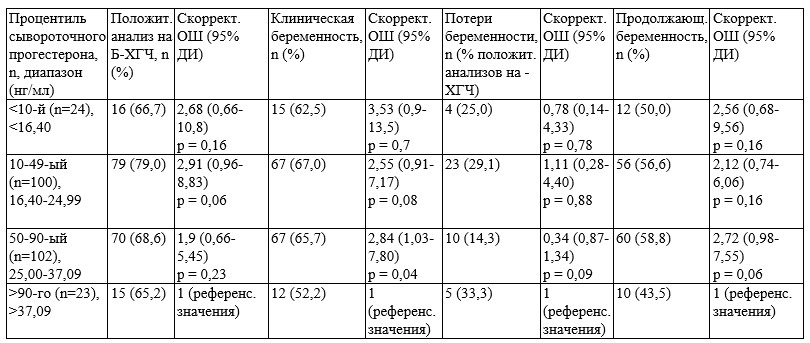
Рис. 1. Обобщенная аддитивная модель, описывающая связь между сывороточной концентрацией прогестерона и скорректированной вероятностью продолжающейся беременности при п/к и вагинальном введении прогестерона. Розовым цветом обозначена группа п/к прогестерона, синим - вагинального. Области с заливкой представляют 95% доверительные интервалы средних скорректированных показателей продолжающейся беременности. Вертикальные пунктирные линии указывают максимальные значения сывороточного прогестерона (нг/мл) в 10-ом (10p), 50-ом (50p) и 90-ом (90p) процентилях соответственно. Отметки «x» на графике обозначают индивидуальные сывороточные концентрации прогестерона с (100%) или без (0%) продолжающейся беременности. Корректировка частоты продолжающихся беременностей проводилась с учетом следующих параметров: возраста пациентки, ИМТ, наличия родов в анамнезе, количества перенесенных бластоцист, дня витрификации бластоцисты, применения неселективной витрификации, ПГТ-А, качества бластоцист, толщины эндометрия, продолжительности бесплодия и количества предыдущих попыток ПЭ. Р-значения для сывороточного прогестерона составили 0,087 и 0,437 при п/к и вагинальном введении соответственно. FET-1 – 1 сутки до переноса размороженной бластоцисты.
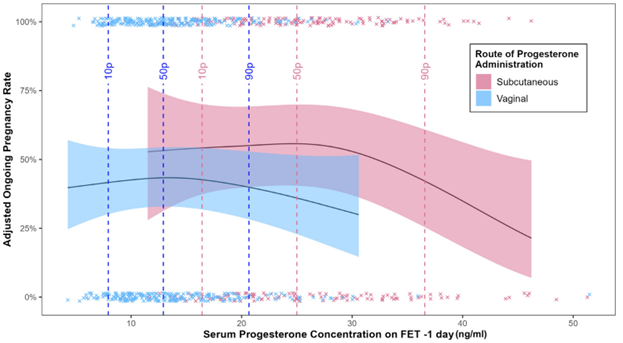
Таблица 4. Скорректированные показатели репродуктивных исходов у пациенток (n=474) в соответствии с процентилями сывороточного прогестерона, измеренного за 1 день до ПЭ в криоциклах на ЗГТ с использованием вагинального геля с прогестероном
Обсуждение
В приведенном когортном исследовании криоциклов на ЗГТ сравнивались два пути введения прогестерона, а именно п/к прогестерон в дозе 25 мг 2 р/сут и вагинальный прогестерон в форме геля в дозе 90 мг 2 р/сут с использованием «протокола спасения» у пациенток с сывороточной концентрацией прогестерона, измеренной за сутки до ПЭ, <8,75 нг/мл (Polat и соавт., 2020) в виде дополнительного п/к введения 25 мг. В общей сложности 15,8% пациенткам из группы вагинального прогестерона потребовалось проведение данного протокола; в группе п/к прогестерона, наоборот, ни в одном из случаев потребность в дополнительном введении экзогенного прогестерона не возникла. Частота продолжающейся беременности в исследуемых группах была сопоставима.
Подход "назад к природе", предусматривающий расширение применения криопереносов в естественном цикле, был предложен и поддержан различными авторами (Lawrenz и соавт., 2020; Roque и соавт., 2019a) ввиду более благоприятных материнских, акушерских и перинатальных исходов в сравнении с криоциклами на ЗГТ (Busnelli и соавт., 2022). Однако, ЗГТ по-прежнему служит наиболее широко используемым протоколом для подготовки эндометрия к имплантации эмбриона как у пациенток с, так и без овуляции (Lee и соавт., 2023; Noble и Child, 2022).
Несмотря на использование одинаковых режимов дозирования прогестерона, были отмечены значительные межличностные различия в концентрациях сывороточного прогестерона как при вагинальном, так и при п/к введении. Согласно имеющимся данным предыдущего (Yarali и соавт., 2021) и двух других исследований (Alvarez и соавт., 2021; Labarta и соавт., 2022), в подгруппе концентрации сывороточного прогестерона <10-го процентиля группы вагинального введения отмечались показатели продолжающейся беременности, аналогичные таковым в подгруппах 10-49-ого, 50-90-г и >90-го процентиля после внедрения «протокола спасения». Важно отметить, что в группе п/к прогестерона проведения «протокола спасения» вовсе не потребовалось. Эти результаты могут свидетельствовать о том, что п/к инъекции прогестерона обеспечивают необходимые для достижения должного уровня продолжающейся беременности сывороточные концентрации прогестерона даже у тех пациенток, которые находятся в подгруппе <10-го процентиля. Однако, при п/к введении частота продолжающейся беременности была численно ниже в подгруппе >90-го процентиля по сравнению с подгруппой 50-90-го процентиля (вероятно, это обусловлено «эффектом потолка»), что, стоит заметить, не имело особого значения. Является ли это истинным проявлением «эффекта потолка», который описан для внутримышечного (Kofinas и соавт., 2015), вагинального (Al yasin и соавт., 2021; Yovich и др., 2015) и п/к прогестерона (Melo и соавт., 2022), еще предстоит изучить.
Несмотря на то, что ЗГТ часто отдается предпочтение при прайминге эндометрия (Lee и соавт., 2023; Noble и Child 2022), оптимальный режим применения прогестерона к настоящему времени не определен. Совсем недавно на фармацевтическом рынке появился водорастворимый прогестерон для внутривенного введения, который можно назначать с целью поддержки лютеиновой фазы в естественном цикле и при переносе размороженных эмбрионов.
В недавнем исследовании, направленном на оценку сравнительной эффективности п/к прогестерона и внутримышечного прогестерона на масляной основе у женщин репродуктивного возраста и в постменопаузе, было отмечено, что при п/к введении максимальные концентрации (C max) прогестерона сыворотки в три раза выше, а время их достижения в восемь раз короче (Sator и соавт., 2013). Эти данные указывают на большую биодоступность п/к прогестерона, при этом площади под кривыми «концентрация-время» (AUC), построенными на основании показателей прогестерона сыворотки крови, сопоставимы в обеих исследуемых группах. В рамках обсуждения профиля безопасности подкожного прогестерона было отмечено, что его назначение ассоциировано с меньшей частотой побочных явлений, их продолжительностью и, в основном, сопровождается местными побочными реакциями. В другом исследовании, оценивающем влияние различных режимов дозирования подкожного прогестерона на ткань эндометрия, результаты гистологического исследования биопсийного материала в группах, получавших 25 мг/сут и 50 мг/сут в течение 11 дней, были сопоставимы (de Ziegler и соавт., 2013). Также сообщалось о схожих репродуктивных исходах при использовании п/к и вагинального прогестерона в качестве поддержки лютеиновой фазы в «свежих» циклах в двух многоцентровых РКИ (Baker и соавт., 2014; Lockwood и соавт., 2014), одном метаанализе индивидуальных данных пациентов (Doblinger и соавт., 2016) и двух ретроспективных исследованиях (Hibshi и соавт., 2020; Schutt и соавт., 2021). Доза подкожно прогестерона в этих исследованиях составляла 25 мг в сутки.
Насколько известно авторам, на сегодняшний день лишь в двух исследованиях проводилась сравнительная оценка эффективности вагинального и подкожного введения прогестерона в криоциклах на ЗГТ (Aflatoonian и Mohammadi, 2021; Turkgeldi и соавт., 2020). В ретроспективном когортном исследовании Turkgeldi и соавт. (2020), включившем 214 циклов криопереноса, в одной группе в качестве лютеиновой поддержки применяли вагинальный гель с прогестероном в дозе 90 мг 2 р/сутки (n=107), в другой – подкожные инъекции прогестерона в дозе 25 мг 2 р/сут (n=107). Уровни биохимической беременности, выкидышей, продолжающейся беременности и живорождений в указанных группах значительно не отличались. К сожалению, данные о сывороточных концентрациях прогестерона в исследовании приведены не были. В другом ретроспективном исследовании, включившем небольшое число циклов криопереноса эмбрионов на стадии дробления на ЗГТ, сравнивалось подкожное введение 25 мг прогестерона в сутки (n=27) и вагинальное введение (n=50) в форме либо пессария с прогестероном в дозе 400 мг 2 р/сут, либо таблеток с прогестероном в дозе 100 мг 3 р/сут (Aflatoonian и Mohammadi, 2021). Хотя частота биохимической и клинической беременностей была выше в группе вагинального прогестерона (40,0% vs 29,6%, p = 0,367; 28,0% vs 22,2%, р = 0,581 соответственно), эта разница не имела статистической значимости (Aflatoonian и Mohammadi, 2021). Следует отметить, что в данном исследовании подкожный прогестерон в дозе 25 мг вводился 1 р/сут, в то время как в исследовании Turkgeldi и соавт. (2020) аналогичная доза использовалась 2 раза в день. Aflatoonian и Mohammadi также не приводили сывороточные концентрации прогестерона в своем исследовании.
В двух исследованиях со схожей выборкой эффективность п/к введения прогестерона сравнивалась с внутримышечным (в/м) введением в криоциклах на ЗГТ (Boynukalin и соавт., 2023; Turgut и соавт., 2020). Одно ретроспективное одноцентровое когортное исследование включило 507 подобных циклов переноса 1 бластоцисты, в которых прогестерон вводился в/м в дозе 50 мг 1 р/сут (n=349) или п/к в дозе 25 мг 2 р/сут (n=158) (Turgut и соавт., 2020). Согласно результатам многомерного логистического регрессионного анализа, способ введения прогестерона (подкожный или в/м) не являлся прогностически значимым фактором живорождения. Совсем недавно та же исследовательская группа опубликовала данные проспективного когортного исследования (Boynukalin и соавт., 2023), в котором также проводилась сравнительная оценка эффективности п/к и в/м введения прогестерона в криоциклах на ЗГТ. Выбор способа введения прогестерона основывался на предпочтениях пациентки и доступности в/м формы для конкретной медицинской организации. Как и в предыдущем исследовании, были получены сопоставимые уровни продолжающейся беременности в группах п/к введения 25 мг прогестерона 2 р/сут (n=133) и в/м введения в дозе 50 мг 1 р/сут (n=91) (48,9% vs 51,6% соответственно; р = 0,683). Забор крови для определения сывороточной концентрации прогестерона проводили непосредственно перед переносом бластоцисты на 6-й день от момента назначения прогестерона и спустя 7 ч после утренней п/к инъекции. Следует отметить, что средние сывороточные концентрации прогестерона были аналогичны в п/к и в/м группах (19,92 vs 21,00 нг/мл соответственно; р = 0,786). В группе п/к введения значимых различий в частоте продолжающейся беременности среди четырех квартилей концентраций сывороточного прогестерона, измеренного в день криопереноса, обнаружено не было. Однако, в группе в/м введения у пациенток с более низкой сывороточной концентрацией прогестерона в 1-ом квартиле (<16,5 нг/мл) отмечалась более низкая частота продолжающейся беременности по сравнению с таковыми, у которых сывороточная концентрация прогестерона соответствовала 2-ому, 3-ому или 4-ому квартилям (р = 0,031). Интересно, что в исследовании Boynukalin и соавт. (2023) пороговая сывороточная концентрация первого квартиля для п/к введения составила 15,2 нг/мл, что ниже примененной в данном исследовании (16,40 нг/мл). Это может объясняться более коротким промежутком между введением утренней дозы п/к прогестерона и временем забора крови на анализ (4-5 ч в текущем исследовании и 7 ч в исследовании Boynukalin и соавт. (2023).
Наконец, недавнее проспективное когортное исследование, проведенное на базе восьми центров ЭКО, было направлено на изучение взаимосвязи между сывороточной концентрацией прогестерона в день переноса эмбриона и вероятностью живорождения у пациенток в криопротоколах с различными режимами поддержки лютеиновой фазы (Melo и соавт., 2022). Забор крови осуществлялся в 12:00-14:00 ч через 4-6 ч после введения последней дозы прогестерона. В группе применения вагинального геля с прогестероном скорректированное на вероятность среднее живорождений увеличивалось линейно с повышением сывороточной концентрации прогестерона, в то время как зависимость живорождений от сывороточной концентрации прогестерона при п/к введении имела форму колоколообразной кривой со снижением средней вероятности живорождения как при низких, так и при высоких показателях прогестерона сыворотки. Повышение средней вероятности живорождения отмечалось до достижения концентрации прогестерона сыворотки 16,3 нг/мл, после чего последняя начинала снижаться. В отличие от исследования Melo и соавт. (2022), в данной работе не было отмечено более низкой скорректированной частоты продолжающейся беременности при сывороточной концентрации прогестерона <10-го процентиля. Важно упомянуть, что пороговым значением для 10-го процентиля в исследовании Melo и соавт. (2022) служил сывороточный уровень прогестерона 10,9 нг/мл, в рассматриваемом исследовании - 16,40 нг/мл; максимальной средней вероятности живорождения в исследовании Melo и соавт. (2022) соответствовала сывороточная концентрация прогестерона, равная 16,30 нг/мл, в текущем исследовании - 37,09 нг/мл. Причинами подобных разночтений могут служить использование различных методик определения сывороточной концентрации прогестерона и малый объем выборки группы п/к прогестерона в исследовании Melo и соавт. (2022).
Субоптимальные концентрации прогестерона сыворотки были ассоциированы с ухудшением репродуктивных исходов при вагинальном (Melo и соавт., 2021; Mumcuoglu и соавт., 2021), внутримышечном (Boynukalin и соавт., 2019; Brady и соавт., 2014) и пероральном (Neumann и соавт., 2022) введении. Однако, причина отсутствия снижения уровня продолжающейся беременности в группе сывороточной концентрации прогестерона <10-го процентиля при п/к введении, отмеченного Melo и соавт. (2022), не определена, что свидетельствует о необходимости дальнейших исследований.
Насколько известно авторам, приведенное исследование по сравнительной эффективности вагинальной и п/к форм прогестерона в криоциклах на ЗГТ имеет наибольший объем выборки. Время между введением последней дозы прогестерона и забором крови в день переноса 1 размороженного эмбриона с целью определения сывороточной концентрации было стандартизовано. Критерии включения в данное исследование охватили все категории пациенток, с которыми приходится сталкиваться в рутинной клинической практике, что позволяет экстраполировать полученные результаты.
Ограничениями данного исследования являются его ретроспективный дизайн, отсутствие анализа экономической эффективности и побочных эффектов, а также отсутствие данных об акушерских, материнских и неонатальных исходах. В текущем исследовании проводился сравнительный анализ п/к и вагинальной форм прогестерона с использованием «протокола спасения» у пациенток с низким сывороточным уровнем прогестерона за сутки до ПЭ, в связи с чем целесообразно дальнейшее проведение РКИ с выделением 3-х групп, а именно: 1) группа подкожного введения прогестерона, 2) вагинального введения геля с прогестероном без применения «протокола спасения» и 3) группа применения вагинального геля с «протоколом спасения».
В заключение стоит упомянуть, что, согласно полученным данным, при п/к введении прогестерона в дозе 25 мг 2 р/сут сывороточная концентрация прогестерона у всех испытуемых была >8,75 нг/мл, в то время как в группе вагинального прогестерона 15,8% пациенток потребовалось применение «протокола спасения», при использовании которого уровень продолжающейся беременности был аналогичен в обеих группах. Необходимы РКИ с большей выборкой для уточнения оптимального пути введения прогестерона, изучения зависимости "доза-ответная реакция" при использовании п/к прогестерона и определения максимально возможной эффективности последнего.
Список литературы:
Aflatoonian, A., Mohammadi, B., 2021. Subcutaneous progesterone versus vaginal progesterone for luteal-phase support in frozenthawed embryo transfer: A cross-sectional study. Int J Reprod Biomed 19, 115–120.
Alvarez, M., Gaggiotti-Marre, S., Martínez, F., Coll, L., García, S., Gonzalez-Foruria, I.,
Rodríguez, I., Parriego, M., Polyzos, N.P., Coroleu, B., 2021. Individualised luteal phase support in artificially prepared frozen embryo transfer cycles based on serum progesterone levels: A prospective cohort study. Hum Reprod 36, 1552–1560.
Alyasin, A., Agha-Hosseini, M., Kabirinasab, M., Saeidi, H., Nashtaei, M.S., 2021. Serum
progesterone levels greater than 32.5 ng/ml on the day of embryo transfer are associated with lower live birth rate after artificial endometrial preparation: A prospective study. Reprod Biol Endocrinol 19, 24.
Baker, V.L., Jones, C.A., Doody, K., Foulk, R., Yee, B., Adamson, G.D., Cometti, B., Devane, G., Hubert, G., Trevisan, S., Hoehler, F., Jones, C., Soules, M., 2014. A randomized, controlled trial comparing the efficacy and safety of aqueous subcutaneous progesterone with vaginal progesterone for luteal phase support of in vitro fertilization. Hum Reprod 29, 2212–2220.
Boynukalin, F.K., Abali, R., Gultomruk, M., Demir, B., Yarkiner, Z., Karlikaya, G., Bahceci, M., De Ziegler, D., 2023. Subcutaneous progesterone provide similar ongoing pregnancy rate compared to intramuscular progesterone in hormone replacement therapy frozen embryo transfer cycles. F&S Reports 4, 165–172. https://doi.org/10.1016/j.xfre.2022.11.002.
Boynukalin, F.K., Gultomruk, M., Turgut, E., Demir, B., Findikli, N., Serdarogullari, M., Coban, O., Yarkiner, Z., Bahceci, M., 2019. Measuring the serum progesterone level on the day of transfer can be an additional tool to maximize ongoing pregnancies in single euploid frozen blastocyst transfers. Reprod Biol Endocrinol 17, 102.
Brady, P.C., Kaser, D.J., Ginsburg, E.S., Ashby, R.K., Missmer, S.A., Correia, K.F., Racowsky, C., 2014. Serum progesterone concentration on day of embryo transfer in donor oocyte cycles. J Assist Reprod Genet 31, 569–575.
Busnelli, A., Schirripa, I., Fedele, F., Bulfoni, A., Levi-Setti, P.E., 2022. Obstetric and perinatal outcomes following programmed compared to natural frozen-thawed embryo transfer cycles: A systematic review and meta-analysis. Hum Reprod 37, 1619–1641.
De Geyter, C., Wyns, C., Calhaz-Jorge, C., De Mouzon, J., Ferraretti, A.P., Kupka, M., Nyboe Andersen, A., Nygren, K.G., Goossens, V., 2020. 20 years of the European IVF-Monitoring Consortium registry: What have we learned? A comparison with registries from two other regions. Hum Reprod 35, 2832–2849.
De Ziegler, D., Sator, M., Binelli, D., Leuratti, C., Cometti, B., Bourgain, C., Fu, Y.S., Garhofer, G. 2013. A randomized trial comparing the endometrial effects of daily subcutaneous administration of 25 mg and 50 mg progesterone in aqueous preparation. Fertil Steril 100, 860– 866.
Doblinger, J., Cometti, B., Trevisan, S., Griesinger, G., 2016. Subcutaneous progesterone is effective and safe for luteal phase support in ivf: An individual patient data metaanalysis of the phase III trials. PLoS One 11, e0151388.
Franasiak, J.M., Forman, E.J., Patounakis, G., Hong, K.H., Werner, M.D., Upham, K.M., Treff, N.R., Scott, Jr., R.T., 2018. Investigating the impact of the timing of blastulation on implantation: Management of embryoendometrial synchrony improves outcomes. Hum Reprod Open hoy022 2018.
Gardner, D.K., Schoolcraft, W.B., 1999. Culture and transfer of human blastocysts. Curr Opin Obstet Gynecol 11, 307–311.
Griesinger, G., Verweij, P.J., Gates, D., Devroey, P., Gordon, K., Stegmann, B.J., Tarlatzis, B.C., 2016. Prediction of ovarian hyperstimulation syndrome in patients treated with corifollitropin alfa or rfsh in a gnrh antagonist protocol. PLoS One 11, e0149615.
Hibshi, A.M., Aldriweesh, A., Saeed, B., CosKun, S., Awartani, K.A., 2020. Subcutaneous progesterone (Prolutex) for luteal phase support in cycles of in vitro fertilization embryo transfer a retrospective cohort study. Clin Obstet Gynecol Reprod Med 6, 1–5. https://doi. org/10.15761/COGRM.1000296.
Kofinas, J.D., Blakemore, J., Mcculloh, D.H., Grifo, J., 2015. Serum progesterone levels. greater than 20 ng/dl on day of embryo transfer are associated with lower live birth and higher pregnancy loss rates. J Assist Reprod Genet 32, 1395–1399.
Labarta, E., Mariani, G., Rodríguez-Varela, C., Bosch, E., 2022. Individualized luteal phase support normalizes live birth rate in women with low progesterone levels on the day of embryo transfer in artificial endometrial preparation cycles. Fertil Steril 117, 96–103.
Labarta, E., Sebastian-Leon, P., Devesa-Peiro, A., Celada, P., Vidal, C., Giles, J., Rodriguez-Varela, C., Bosch, E., Diaz-Gimeno, P., 2021. Analysis of serum and endometrial progesterone in determining endometrial receptivity. Human Reproduction 36, 2861–2870.
Lawrenz, B., Coughlan, C., Melado, L., Fatemi, H.M., 2020. The art of frozen embryo transfer: Back to nature!. Gynecol Endocrinol 36, 479–483.
Lee, J.C., Calzada-Jorge, N.S., Hipp, H.S., Kawwass, J.F., 2023. Natural cycle frozen embryo transfer: A survey of current assisted reproductive technology practices in the U.S. J. Assist. Reprod. Genetics 40, 891–899. https://doi.org/10.1007/s10815-023-02751-w.
Lockwood, G., Griesinger, G., Cometti, B., 2014. Subcutaneous progesterone versus vaginal progesterone gel for luteal phase support in in vitro fertilization: A noninferiority randomized controlled study. Fertil Steril 101, 112–119 e113.
Melo, P., Chung, Y., Pickering, O., Price, M.J., Fishel, S., Khairy, M., Kingsland, C., Lowe, P., Petsas, G., Rajkhowa, M., Sephton, V., Tozer, A., Wood, S., Labarta, E., Wilcox, M., Devall, A., Gallos, I., Coomarasamy, A., 2021. Serum luteal phase progesterone in women undergoing frozen embryo transfer in assisted conception: A systematic review and meta-analysis. Fertil Steril 116, 1534–1556.
Melo, P., Wood, S., Petsas, G., Chung, Y., Easter, C., Price, M.J., Fishel, S., Khairy, M., Kingsland, C., Lowe, P., Rajkhowa, M., Sephton, V., Pandey, S., Kazem, R., Walker, D., Gorodeckaja, J., Wilcox, M., Gallos, I., Tozer, A., Coomarasamy, A., 2022. The effect of frozen embryo transfer regimen on the association between serum progesterone and live birth: A multicentre prospective cohort study (profet). Human Reproduction Open 2022, hoac054. https://doi.org/10.1093/hropen/hoac054.
Miles, R.A., Paulson, R.J., Lobo, R.A., Press, M.F., Dahmoush, L., Sauer, M.V., 1994. Pharmacokinetics and endometrial tissue levels of progesterone after administration by intramuscular and vaginal routes: A comparative study. Fertility and Sterility 62, 485–490.
Mumusoglu, S., Polat, M., Ozbek, I.Y., Bozdag, G., Papanikolaou, E.G., Esteves, S.C., Humaidan, P., Yarali, H., 2021. Preparation of the endometrium for frozen embryo transfer: A systematic review. Front Endocrinol (Lausanne) 12, 688237.
Mumusoglu, S., Yarali, I., Bozdag, G., Ozdemir, P., Polat, M., Sokmensuer, L.K., Yarali, H., 2017. Time-lapse morphokinetic assessment has low to moderate ability to predict euploidy when patient- and ovarian stimulation-related factors are taken into account with the use of clustered data analysis. Fertil Steril 107, 413–421 e414.
Neumann, K., Masuch, A., Vonthein, R., Depenbusch, M., Schultze-Mosgau, A., Eggersmann, T.K., Griesinger, G., 2022. Dydrogesterone and 20adihydrodydrogesterone plasma levels on day of embryo transfer and clinical outcome in an anovulatory programmed frozen-thawed embryo transfer cycle: A prospective cohort study. Human Reproduction 37, 1183–1193.
Noble, M., Child, T., 2022. A uk-wide cross-sectional survey of practice exploring current trends in endometrial preparation for frozen-thawed embryo replacement. Hum Fertil (Camb) 25, 283–290.
Polat, M., Mumusoglu, S., Bozdag, G., Ozbek, I.Y., Humaidan, P., Yarali, H., 2020. Addition of intramuscular progesterone to vaginal progesterone in hormone replacement therapy in vitrified-warmed blastocyst transfer cycles. Reprod Biomed Online 40, 812–818.
Ranisavljevic, N., Huberlant, S., Montagut, M., Alonzo, P.M., Darne, B., Languille, S., Anahory, T., Cedrin-Durnerin, I., 2022. Low luteal serum progesterone levels are associated with lower ongoing pregnancy and live birth rates in art: Systematic review and meta-analyses. Front Endocrinol (Lausanne) 13, 892753.
Roque, M., Bedoschi, G., Cecchino, G.N., Esteves, S.C., 2019a. Fresh versus frozen blastocyst transfer. Lancet 394, 1227–1228. Roque, M., Haahr, T., Geber, S., Esteves, S.C., Humaidan, P., 2019b. Fresh versus elective frozen embryo transfer in ivf/icsi cycles: A systematic review and meta-analysis of reproductive outcomes. Hum Reprod Update 25, 2–14.
Sator, M., Radicioni, M., Cometti, B., Loprete, L., Leuratti, C., Schmidl, D., Garhofer, G., 2013. Pharmacokinetics and safety profile of a novel progesterone aqueous formulation administered by the s.C. Route. Gynecological Endocrinology 29, 205–208.
Schutt, M., Nguyen, T.D., Kalff-Suske, M., € Wagner, U., Macharey, G., Ziller, V., 2021. Subcutaneous progesterone versus vaginal progesterone for luteal phase support in in vitro fertilization: A retrospective analysis from daily clinical practice. Clin Exp Reprod Med 48, 262– 267.
Turgut, E.N., Boynukal{n, F.K., Gultomruk, M., Yarkner, Z., Bahceci, M., 2020. Comparison of ¸ intramuscular versus subcutaneous aqueous progesterone for luteal phase support in artificially prepared frozen embryo transfer cycles. Turk J Obstet Gynecol 17, 240–246. RBMO VOLUME 00 ISSUE 00 2023 9
Turkgeldi, E., Hanege, B.Y., Yildiz, S., Keles, I., Ata, B., 2020. Subcutaneous versus vaginal progesterone for vitrified-warmed blastocyst transfer in artificial cycles. Reprod Biomed Online 41, 248–253.
Venetis, C.A., Kolibianakis, E.M., Bosdou, J.K., Tarlatzis, B.C., 2013. Progesterone elevation and probability of pregnancy after ivf: A systematic review and meta-analysis of over 60 000 cycles. Human Reproduction Update 19, 433–457.
Wirleitner, B., Schuff, M., Stecher, A., Murtinger, M., Vanderzwalmen, P., 2016. Pregnancy and birth outcomes following fresh or vitrified embryo transfer according to blastocyst morphology and expansion stage, and culturing strategy for delayed development. Hum Reprod 31, 1685–1695.
Wood, S.N., 2011. Fast stable restricted maximum likelihood and marginal likelihood estimation of semiparametric generalized linear models. Journal of the Royal Statistical Society: Series B (Statistical Methodology) 73, 3–36.
Yarali, H., Polat, M., Mumusoglu, S., Ozbek, I.Y., Erden, M., Bozdag, G., Humaidan, P., 2021. Subcutaneous luteal phase progesterone rescue rectifies ongoing pregnancy rates in hormone replacement therapy vitrified-warmed blastocyst transfer cycles. Reprod Biomed Online 43, 45–51.
Young, S.L., Savaris, R.F., Lessey, B.A., Sharkey, A.M., Balthazar, U., Zaino, R.J., Sherwin, R.A., Fritz, M.A., 2017. Effect of randomized serum progesterone concentration on secretory endometrial histologic development and gene expression. Hum Reprod 32, 1903–1914.
Yovich, J.L., Conceicao, J.L., Stanger, J.D., Hinchliffe, P.M., Keane, K.N., 2015. Mid-luteal serum progesterone concentrations govern implantation rates for cryopreserved embryo transfers conducted under hormone replacement. Reprod Biomed Online 31, 180–191.

 вернуться к списку
вернуться к списку



