Статьи
Влияние преждевременного повышения сывороточного уровня прогестерона в день введения триггера на исходы программ ВРТ 6 мая 2024
Влияние преждевременного повышения сывороточного уровня прогестерона в день введения триггера, частота которого составляет от 12% до 46% (в зависимости от используемого порового значения) [1], на исходы программ вспомогательных репродуктивных технологий (ВРТ) служит предметом дискуссий на протяжении нескольких десятилетий.
Впервые связь уровня прогестерона сыворотки крови (Р4) > 0,5 нг/мл с более низкой частотой наступления беременности была продемонстрирована Schoolcraft W и соавт. еще в 1991 г. [2]. Позднее, в 2010 г., было показано, что уровень сывороточного Р4 >1,5 нг/мл в день введения триггера финального созревания ооцитов - хорионического гонадотропина человека (ХГЧ) – ассоциирован со значительным снижением частоты продолжающейся беременности в циклах ВРТ вне зависимости от того, какой препарат используется для профилактики преждевременного пика эндогенного лютеинизирующего гормона (ЛГ): агонист или антагонист гонадотропин-рилизинг-гормона (ГнРГ) (рис. 1) [3].
Рис. 1. Зависимость частоты продолжающейся беременности от овариального ответа и сывороточных уровней прогестерона
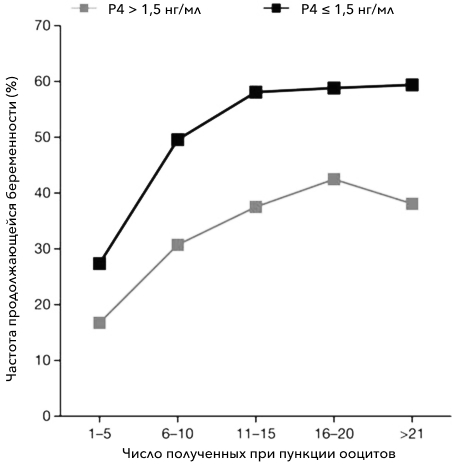
В крупном систематическом обзоре и мета-анализе, включившем 63 исследования, оценивающих результаты 55 199 протоколов экстракорпорального оплодотворения (ЭКО) в свежем цикле, 9 исследований, оценивающих результаты 7229 криоциклов, и 8 исследований, оценивающих 1330 циклов с донорскими яйцеклетками, подтвердилась статистически значимая ассоциация уровня сывороточного Р, равного 1,5–1,75 нг/мл, со снижением частоты наступления беременности (отношение шансов (ОШ): 0,64, 95% доверительный интервал (ДИ): 0,54–0,76) в программах переноса эмбриона в естественном цикле со стимуляцией овуляции, в то время как подобная ассоциация в криоциклах и циклах донорских ооцитов отсутствовала [1]. Griesinger G и соавт. отметили, что эта взаимосвязь также отсутствует при переносе эмбриона в естественном цикле у пациенток с избыточным ответом яичников на стимуляцию [4]. Несмотря на то, что наиболее распространенным предиктором неудачи ВРТ остается сывороточный уровень прогестерона выше >1,5 нг/мл, используемые в клинической практике пороговые значения весьма разнообразны и варьируют от 0.4 до 3 нг/мл [5].
Патофизиологические механизмы преждевременного повышения сывороточного уровня Р4 до конца не определены и могут быть обусловлены избыточным синтезом прогестерона тека-клетками большого количества созревающих фолликулов, а также прямым стимулирующим действием экзогенного фолликулостимулирующего гормона (ФСГ) на гранулезные клетки посредством индукции 3β-гидроксистероиддегидрогеназы [6].
Неблагоприятный репродуктивный эффект повышения Р4 в позднюю фолликулярную фазу, по-видимому, вызван его влиянием на рецептивность эндометрия [7] с нарушением синхронности его развития с эмбрионом [8], что не приводит к снижению качества последнего [9], однако сопровождается снижением частоты имплантации. Экспериментально были получены убедительные данные о том, что повышенный сывороточный уровень P4 приводит к ускоренному гистологическому созреванию эндометрия [10], значительному изменению экспрессии генов, определяющих рецептивность и иммунный ответ эндометрия, за счет эпигенетических механизмов [11, 12], нарушению липидного гомеостаза эндометрия и гиперметилированию ДНК со снижением экспрессии молекул адгезии клеток последнего[13].
На сегодняшний день наиболее рациональной тактикой при обнаружении сывороточного уровня Р4 в день введения триггера более 1,5 нг/мл является сегментация цикла с замораживанием полученных при стимуляции ооцитов и их переносом в следующемцикле [14]. Возможными путями снижения риска преждевременной лютеинизации служат использование протоколов с антагонистами ГнРГ [1], а также снижение дозы рекомбинантного ФСГ или замена последнего корифоллитропином альфа, применение которого было ассоциировано со снижением частоты последней с 18,3% до 5,4% [15].
Важной проблемой, сохраняющей свою актуальность, служит унифицирование измерения показателей сывороточного прогестерона. Так, в проспективном когортном исследовании 2019 г. средняя разница сывороточного Р4, определяемого в 8:00 и 20:00, составила 0,77 нг/мл, при этом у 70% пациенток с уровнем сывороточного Р4 выше порогового значения в 8:00 при последующем измерении в более поздние часы достижения 1,5 нг/мл не отмечалось [16]. В другом исследовании аналогичного дизайна также наблюдалось снижение уровня сывороточного прогестерона в среднем на 37,8% между первой и последней пробами (забор крови осуществлялся 4 раза: в 8:00, 11:00, 14:00 и 17:00) [17]. Также были отмечены значительные колебания результатов определения Р4 сыворотки в зависимости от используемого анализатора, например, по данным Roper SM и соавт., система иммуноанализа Siemens ADVIA Centaur склонна переоценивать концентрацию сывороточного Р4 на 19%, а система Abbott Architect - на 5% [18].
Таким образом, преждевременное повышение сывороточного уровня Р4 в день введения триггера достоверно ассоциировано со снижением частоты имплантации и, как следствие, родов живым плодом, в связи с чем рекомендована сегментация цикла при уровне последнего выше 1,5 нг/мл. Важной задачей видится стандартизация методики забора и анализа крови с целью получения наиболее адекватных значений, напрямую определяющих тактику репродуктолога.
Литература:
-
Venetis CA, Kolibianakis EM, Bosdou JK, Tarlatzis BC. Progesterone elevation and probability of pregnancy after IVF: A systematic review and meta-analysis of over 60 000 cycles. Hum Reprod Update. 2013;19:433–57.
-
Schoolcraft W, Sinton E, Schlenker T, Huynh D, Hamilton F, Meldrum DR. Lower pregnancy rate with premature luteinization during pituitary suppression with leuprolide acetate. Fertil Steril. 1991;55:563–6.
-
Bosch E, Labarta E, Crespo J, Simon C, Remohi J, Jenkins J, et al. Circulating progesterone levels and ongoing pregnancy rates in controlled ovarian stimulation cycles for in vitro fertilization: analysis of over 4000 cycles. Hum Reprod. (2010) 25:2092–100. doi: 10.1093/humrep/deq125.
-
Griesinger G, Mannaerts B, Andersen CY, Witjes H, Kolibianakis EM, Gordon K. Progesterone elevation does not compromise pregnancy rates in high responders: a pooled analysis of in vitro fertilization patients treated with recombinant follicle-stimulating hormone/gonadotropin-releasing hormone antagonist in six trials. Fertil Steril. (2013) 100:1622–8.e1–3. doi: 10.1016/j.fertnstert.2013.08.045.
-
Gurunath S. Premature Progesterone Elevation in in vitro Fertilisation Cycles - Current Perspectives. J Hum Reprod Sci. 2022 Oct-Dec;15(4):325-336. doi: 10.4103/jhrs.jhrs_162_22.
-
Oktem O, Akin N, Bildik G, Yakin K, Alper E, Balaban B, et al. FSH Stimulation promotes progesterone synthesis and output from human granulosa cells without luteinization. Hum Reprod. 2017;32:643–52.
-
Melo MA, Meseguer M, Garrido N, Bosch E, Pellicer A, Remohi J. The significance of premature luteinization in an oocyte-donation programme. Hum Reprod. 2006;21:1503–7. doi: 10.1093/humrep/dei4747.
-
Achache H, Revel A. Endometrial receptivity markers, the journey to successful embryo implantation. Hum Reprod Update. (2006) 12:731–46. doi: 10.1093/humupd/dml004.
-
Xiong Y, Wang J, Liu L, Chen X, Xu H, Li TC, et al. Effects of high progesterone level on the day of human chorionic gonadotrophin administration in in vitro fertilization cycles on epigenetic modification of endometrium in the peri-implantation period. Fertil Steril. (2017) 108:269–76.e1. doi: 10.1016/j.fertnstert.2017.06.004.
-
Saadat P, Boostanfar R, Slater CC, Tourgeman DE, Stanczyk FZ, Paulson RJ. Accelerated endometrial maturation in the luteal phase of cycles utilizing controlled ovarian hyperstimulation: impact of gonadotropin-releasing hormone agonists versus antagonists. Fertil Steril. (2004) 82:167–71. doi: 10.1016/j.fertnstert.2003.11.050.
-
Labarta E, Martinez-Conejero JA, Alama P, Horcajadas JA, Pellicer A, Simon C, et al. Endometrial receptivity is affected in women with high circulating progesterone levels at the end of the follicular phase: a functional genomics analysis. Hum Reprod. (2011) 26:1813–25. doi: 10.1093/humrep/der126.
-
Arck PC, Hecher K. Fetomaternal immune cross-talk and its consequences for maternal and offspring's health. Nat Med. (2013) 19:548–56. doi: 10.1038/nm.3160.
-
Xiong Y, Hu L, Zhang T, Wang M, Xu H, Li TC, et al. Effects of high progesterone in in-vitro fertilization cycle on DNA methylation and gene expression of adhesion molecules on endometrium during implantation window. J Assist Reprod Genet. 2020;37:33–43.
-
Shapiro BS, Daneshmand ST, Garner FC, Aguirre M, Hudson C, Thomas S. Embryo cryopreservation rescues cycles with premature luteinization, Fertil Steril, 2010, vol. 93 (pg. 636-641)
-
Lawrenz B, Beligotti F, Engelmann N, Gates D, Fatemi HM. Impact of gonadotropin type on progesterone elevation during ovarian stimulation in GnRH antagonist cycles. Hum Reprod. 2016;31:2554–60.
-
González-Foruria I, Rodríguez I, Martínez F, Rodríguez-Purata J, Montoya P, Rodríguez D, et al. Clinically significant intra-day variability of serum progesterone levels during the final day of oocyte maturation: A prospective study with repeated measurements. Hum Reprod. 2019;34:1551–8.
-
Shanker U, Lawrenz B, Bungum L, Depret Bixio L, Ruiz F, Coughlan C, et al. Significant serum progesterone variations on the day of final oocyte maturation in stimulated IVF cycles. Front Endocrinol (Lausanne) 2019;10:806.
-
Roper SM, Rubin JR, Ali M, Gibbons WE, Zarutskie PW, Devaraj S. Accuracy of two progesterone immunoassays for monitoring in vitro fertilization. J Appl Lab Med. 2018;2:770–6.

 вернуться к списку
вернуться к списку



