Статьи
Взаимосвязь применяемого триггера овуляции с риском развития недостаточности лютеиновой фазы 6 мая 2024
В естественном цикле желтое тело вырабатывает необходимое количество прогестерона до тех пор, пока эту функцию на себя не берет плацента. Проведение ЭКО в стимулированномцикле с образованием множества желтых тел сопряжено с нарушением синтеза прогестерона, характеризующегося недостаточностью лютеиновой фазы (НЛФ), при которой эндогенного прогестерона оказывается недостаточно для имплантации эмбриона, что приводит к потерям беременности и бесплодию [1, 2].
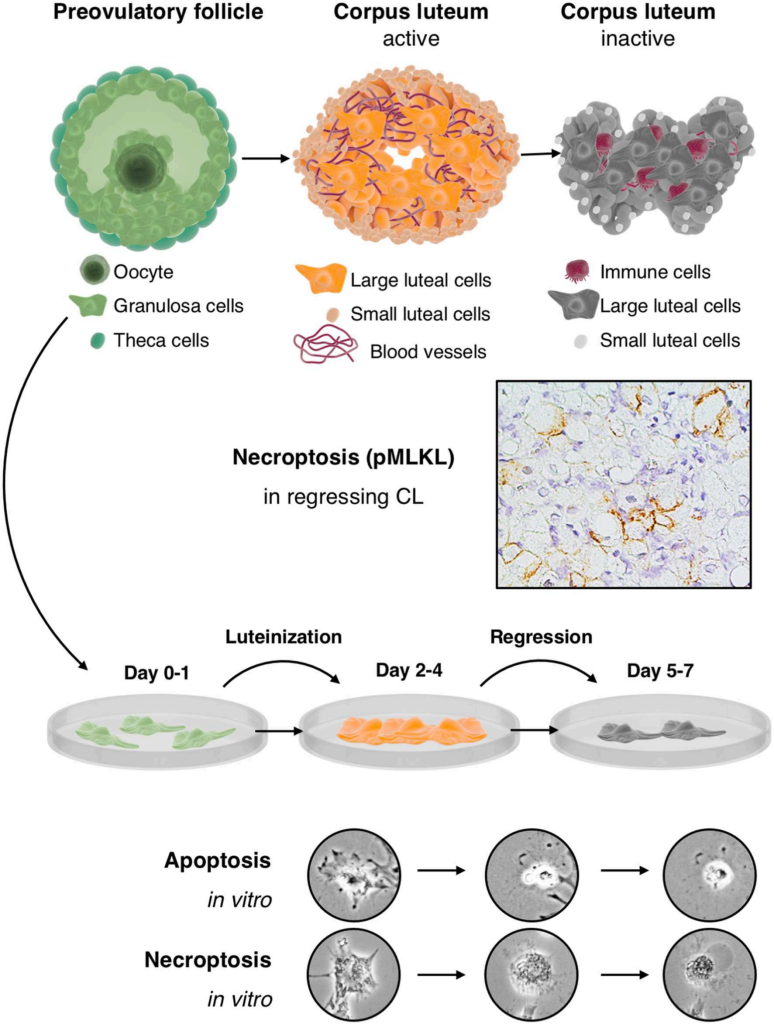
Наиболее клинически подтвержденными на сегодняшний день являются две теории НЛФ [3]. Согласно первой из них, последняя объясняется преждевременным лютеолизом (патогенез лютеолиза представлен на рис. 1), т.е. сокращением длительности ЛФ вследствие продукции большого количества стероидов множеством желтых тел, образовавшихся после аспирации фолликулов, по механизму прямой отрицательной обратной связи в раннюю ЛФ подавляющихсекрецию лютеинизирующего гормона (ЛГ) гипофизом. Согласно второй теории, в основе НЛФ в программированных циклах лежит чрезмерное подавление секреции ЛГ при применении агонистов (а) и антагонистов (ант) гонадотропин-рилизинг-гормона (ГнРГ), при этом введение антГнРГ приводит к немедленному подавлению продукции гонадотропинов (в первую очередь, ЛГ) гипофизом, введение аГнРГ — после предварительной «фазы активации». Также было высказано предположение, что подобным образом ингибирует синтез прогестерона инъекция хорионического гонадотропина человека (ХГЧ). Ввиду вышесказанного возникает вопрос: влияет ли выбор триггера овуляции на выраженность НЛФ и объем необходимой поддержки препаратами экзогенного прогестерона?
Рис. 1. Патогенез лютеолиза
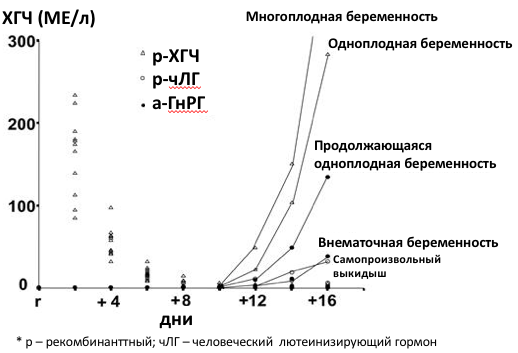
Отмечено, что при индукции финального созревания ооцитов болюсной дозой аГнРГ в сравнении с инъекцией ХГЧ продолжительность лютеиновой фазы короче (9 дней и 13 дней соответственно), а уровни прогестерона и эстрадиола в сыворотке крови ниже [4], что служит проявлением лютеиновой недостаточности и требует назначения более интенсивной поддержки лютеиновой фазы с целью обеспечения надлежащей частоты имплантации эмбриона [5]. С целью предотвращения НЛФ было предложено использование двойного триггера овуляции с добавлением к аГнРГ низких доз ХГЧ. Shapiro BS и соавт. было показано, что добавление 1000 или 2500 МЕ ХГЧ (из расчета 26,2 МЕ на кг массы тела) повышало вероятность наступления клинической беременности и сопровождалось более низкой частотой синдрома гиперстимуляции яичников (СГЯ) [6]. В качестве наиболее разумной стратегии профилактики СГЯ при использовании в качестве триггера аГнРГ принято добавление низких уровней ХГЧ (1000 МЕ) при пиковом уровне эстрадиола <4000 пг/мл [5], при этом инъекция ХГЧ эффективна как при ее проведении в комплексе с аГНРГ, так и через 35 ч после введения последнего. Так, частота родов живым плодом была аналогична в группах введения 1000 МЕ ХГЧ одновременно с триггером финального созревания ооцитов и инъекции ХГЧ при пункции ооцитов [7]. Учет риска СГЯ при выборе триггера крайне важен: при определении в ходе ультразвукового мониторинга > 25 фолликулов диаметром ≥ 11 мм от использования аГнРГ в качестве триггера овуляции рекомендовано воздержаться [8]
Бесконтрольное назначение двойного триггера овуляции не рекомендуется. Так, при изучении сравнительной эффективности назначения в качестве триггера в стимулированных циклах с летрозолом аГнРГ, ХГЧ и их комбинации, в группе аГнРГ и ХГЧ отмечалась более низкая частота самопроизвольного выкидыша (скорректированное отношение шансов (сОШ) = 0,484, 95% доверительный интервал (ДИ): 0,244–0,962, р = 0,038 и сОШ = 0,395, 95% ДИ: 0,196–0,798, р = 0,010 соответственно) [9]. Частота родов живым плодов составила в группе ХГЧ - 40,2%, аГнРГ - 38,2%, двойного триггера - 38,2%. В целом, статистически значимых различий в исходах беременностей среди указанных групп обнаружено не было (рис. 2).
Рис. 2. Клинические исходы при использовании различных триггеров овуляции
При оценке влияния дозы ХГЧ в свежих циклах на уровни сывороточного прогестеронабыла выявлена прямо пропорциональная зависимость последних от дозы ХГЧ, при этом сывороточные уровни прогестерона достоверно различались при назначении 5000, 6500 и 10000 МЕ ХГЧ на 8, 10 и 14 дни после пункции ооцитов (p <0,001), однако значимого влияния дозы ХГЧ на частоту наступления клинической беременности выявлено не было, в связи с чем с целью профилактики СГЯ рекомендовано назначать в качестве триггера дозу, равную 5000 МЕ [10].
Таким образом, выбор триггера финального созревания ооцитов влияет на риск НЛФ. При назначении в качестве триггера аГнРГ следует назначать более высокие дозы экзогенного прогестерона с целью обеспечения надлежащей частоты имплантации. У пациенток с высоким риском СГЯ следует рассмотреть возможность использования двойного триггера овуляции. Важно отметить, что любой протокол стимуляции ассоциирован с риском НЛФ, в связи с чем поддержка лютеиновой фазы служит важнейшим инструментом достижения наилучших результатов программ вспомогательных репродуктивных технологий, при этом при определении объема последней следует применять персонифицированный подход с детальным анализом анамнеза и исходов предыдущих попыток ЭКО.
Литература:
-
Practice Committee of the American Society for Reproductive Medicine. Current clinical irrelevance of luteal phase deficiency: A committee opinion. Fertil Steril.2015; 103: e27–e32.
-
Andersen CY, Fischer R, Giorgione V, Kelsey ThW. Micro-dose hCG as luteal phase support without exogenous progesterone administration: Mathematical modelling of the hCG concentration in circulation and initial clinical experience. J Assist Reprod Genet. 2016; 33: 1311–1318.
-
Van der Linden M, Buckingham K, Farquhar C, Kremer JA, Metwally M. Luteal phase support for assisted reproduction cycles. The Cochrane Database of Systematic Reviews. 2015; 2015(7): CD009154. https://doi.org/10.1002/14651858.CD009154.pub3.
-
Beckers NGM, Macklon NS, Eijkemans MJ, Ludwig M, Felberbaum RE, Diedrich K, et al. Nonsupplemented luteal phase characteristics after the administration of recombinant human chorionic gonadotropin, recombinant luteinizing hormone, or gonadotropin-releasing hormone (GnRH) agonist to induce final oocyte maturation in in vitro fertilization patients after ovarian stimulation with recombinant follicle-stimulating hormone and GnRH antagonist cotreatment. J Clin Endocrinol Metab. 2003; 88: 4186–4192.
-
Benadiva C, Engmann L. Luteal phase support after gonadotropin-releasing hormone agonist triggering: Does it still matter? Fertil Steril. 2018; 109: 763–767.
-
Shapiro BS, Daneshmand ST, Garner FC, Aguirre M, Hudson C. Comparison of “triggers” using leuprolide acetate alone or in combination with low-dose human chorionic gonadotropin. Fertil Steril. 2011; 95: 2715–2717.
-
Maslow BL, Griffin D, Benadiva CA, Nulsen J, Engmann L. Prospective double-blind randomized placebo controlled clinical trial comparing pregnancy rates after co-administration of low dose HCG at the time of GnRH-agonist trigger or 35 hours later, for the prevention of OHSS. Fertil Steril. 2016; 106 (Suppl.): e58.
-
Castillo JC, Haahr Th, Martínez-Moya M, Humaidan P. Gonadotropin-releasing hormone agonist for ovulation trigger-OHSS prevention and use of modified luteal phase support for fresh embryo transfer. Ups J Med Sci. 2020;125: 131–137.
-
Guan L, Wu H, Li Y, Yang M, Xiang S, Lian F. Effect of Triggering with hCG Alone, GnRH Agonist Alone, or in Combination (Dual Trigger) in Letrozole-Stimulated Cycles for Frozen-Thawed Embryo Transfer: A Retrospective Cohort Study. 2024; PREPRINT (Version 1). https://doi.org/10.21203/rs.3.rs-3840013/v1.
-
Svenstrup L, Möller S, Fedder J, Pedersen DE, Erb K, Andersen CY, Humaidan P. Does the HCG trigger dose used for IVF impact luteal progesterone concentrations? a randomized controlled trial. Reprod Biomed Online. 2022; 45(4): 793-804.

 вернуться к списку
вернуться к списку



